
Struktura, vlastnosti a použití oxidu boritého (B2O3)
The oxid boritý nebo anhydrid kyseliny borité je anorganická sloučenina, jejíž chemický vzorec je BdvaNEBO3. Protože bór a kyslík jsou prvky bloku p periodické tabulky a ještě více hlav jejich příslušných skupin, rozdíl elektronegativity mezi nimi není příliš vysoký; proto lze očekávat, že BdvaNEBO3 má kovalentní povahu.
BdvaNEBO3 Připravuje se rozpuštěním boraxu v koncentrované kyselině sírové v tavicí peci a při teplotě 750 ° C; tepelně dehydratující kyselina boritá, B (OH)3, při teplotě přibližně 300 ° C; nebo může být také vytvořen jako reakční produkt diboranu (BdvaH6) s kyslíkem.

Oxid boritý může mít poloprůhledný sklovitý nebo krystalický vzhled; druhou lze mletím získat ve formě prášku (horní obrázek).
Ačkoli se to na první pohled nemusí zdát, považuje se to za B.dvaNEBO3 jako jeden z nejsložitějších anorganických oxidů; nejen ze strukturálního hlediska, ale také kvůli variabilním vlastnostem získaným skly a keramikou, ke kterým se přidává do jejich matice.
Rejstřík článků
- 1 Struktura oxidu boritého
- 1,1 jednotka BO3
- 1.2 Krystalová struktura
- 1.3 Skelná struktura
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Molekulová hmotnost
- 2.3 Příchuť
- 2.4 Hustota
- 2.5 Teplota tání
- 2.6 Bod varu
- 2.7 Stabilita
- 3 Názvosloví
- 4 použití
- 4.1 Syntéza halogenidů boru
- 4.2 Insekticid
- 4.3 Rozpouštědlo oxidů kovů: tvorba skla, keramiky a slitin boru
- 4.4 Pojivo
- 5 Reference
Struktura oxidu boritého
BO jednotka3
BdvaNEBO3 je kovalentní pevná látka, takže teoreticky ve své struktuře nejsou žádné ionty B.3+ ani Odva-, ale B-O odkazy. Bor podle teorie valenčních vazeb (TEV) může tvořit pouze tři kovalentní vazby; v tomto případě tři B-O vazby. V důsledku toho musí být očekávaná geometrie trigonální, BO3.
Molekula BO3 má nedostatek elektronů, zejména atomy kyslíku; několik z nich však může vzájemně interagovat, aby dodalo uvedený nedostatek. Tedy trojúhelníky BO3 spojit se sdílením kyslíkového můstku a jsou distribuovány v prostoru jako sítě trojúhelníkových řad s jejich rovinami orientovanými různými způsoby.
Krystalická struktura
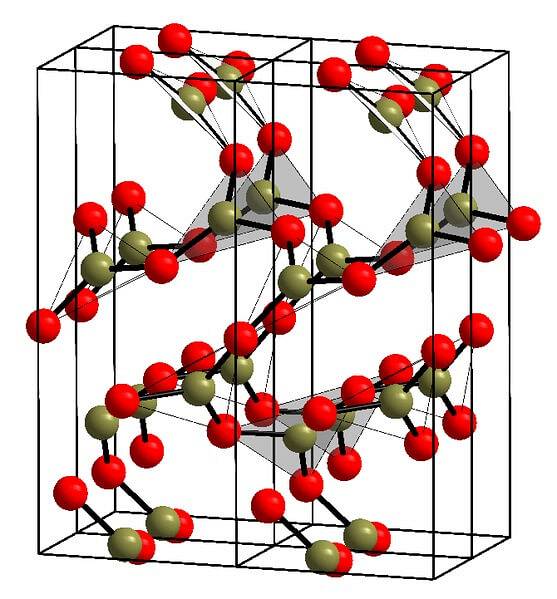
Příklad takových řádků s trojúhelníkovými jednotkami BO je zobrazen na obrázku výše.3. Pokud se podíváte pozorně, ne všechny tváře plánů směřují k čtenáři, ale naopak. Orientace těchto ploch mohou být zodpovědné za to, jak je definováno B.dvaNEBO3 při určité teplotě a tlaku.
Pokud mají tyto sítě strukturní strukturu dlouhého dosahu, jedná se o krystalickou pevnou látku, kterou lze postavit z její jednotkové buňky. Zde se říká, že BdvaNEBO3 má dva krystalické polymorfy: α a β.
Α-BdvaNEBO3 vyrábí se při tlaku okolí (1 atm) a říká se o něm, že je kineticky nestabilní; ve skutečnosti je to jeden z důvodů, proč je oxid boritý pravděpodobně obtížně krystalizovatelnou sloučeninou.
Druhý polymorf, β-BdvaNEBO3, získává se při vysokých tlacích v rozmezí GPa; proto musí být jeho hustota větší než hustota α-BdvaNEBO3.
Skelná struktura
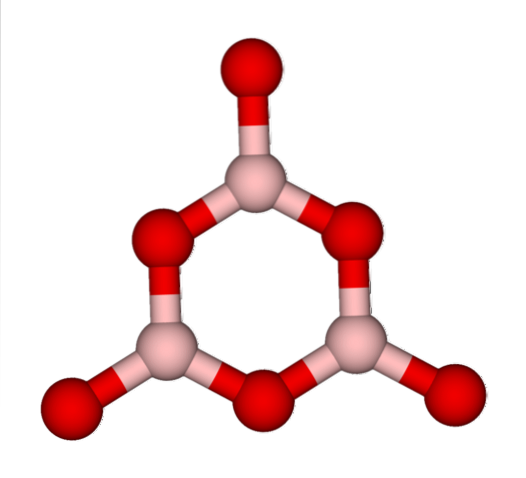
Sítě BO3 přirozeně mají tendenci přijímat amorfní struktury; Jedná se o to, že jim chybí vzor, který popisuje molekuly nebo ionty v pevné látce. Při syntéze BdvaNEBO3 jeho převládající forma je amorfní a ne krystalická; správnými slovy: je to pevná hmota více sklovitá než krystalická.
Pak se říká, že BdvaNEBO3 je skelný nebo amorfní, když má své BO sítě3 jsou špinavé. Nejen to, ale také mění způsob, jakým se scházejí. Místo toho, aby byly uspořádány do trigonální geometrie, nakonec se spojí a vytvoří to, co vědci nazývají boroxolový kruh (horní obrázek).
Všimněte si zjevného rozdílu mezi trojúhelníkovými a šestihrannými jednotkami. Trojúhelníky charakterizují BdvaNEBO3 krystalický a šestihranný k BdvaNEBO3 sklovitý. Jiným způsobem, jak tuto amorfní fázi označit, je bórové sklo nebo vzorec: g-BdvaNEBO3 (písmeno „g“ pochází ze slova glassy v angličtině).
Tedy sítě g-BdvaNEBO3 jsou složeny z boroxolových kruhů a ne BO jednotek3. Avšak g-BdvaNEBO3 může krystalizovat na α-BdvaNEBO3, což by znamenalo vzájemnou přeměnu prstenů na trojúhelníky a také by definovalo dosažený stupeň krystalizace.
Vlastnosti
Fyzický vzhled
Je to bezbarvá, sklovitá pevná látka. Ve své krystalické formě je bílý.
Molekulová hmotnost
69,6182 g / mol.
Chuť
Mírně hořké
Hustota
-Krystalický: 2,46 g / ml.
-Sklivce: 1,80 g / ml.
Bod tání
Nemá plně definovanou teplotu tání, protože záleží na tom, jak je krystalický nebo skelný. Čistě krystalická forma taje při 450 ° C; skelná forma se však taví v teplotním rozmezí od 300 do 700 ° C..
Bod varu
Znovu se vykazované hodnoty neshodují s touto hodnotou. Zdá se, že kapalný oxid boritý (roztavený z jeho krystalů nebo ze skla) se vaří při 1860 ° C.
Stabilita
Musí být udržován v suchu, protože absorbuje vlhkost, aby se přeměnil na kyselinu boritou, B (OH)3.
Nomenklatura
Oxid boritý lze pojmenovat jinými způsoby, například:
-Oxid diboritý (systematické názvosloví).
-Oxid boritý (základní názvosloví).
-Oxid boritý (tradiční nomenklatura).
Aplikace
Některá použití oxidu boritého jsou:
Syntéza halogenidů boru
Od B.dvaNEBO3 mohou být syntetizovány halogenidy boru, BX3 (X = F, Cl a Br). Tyto sloučeniny jsou Lewisovy kyseliny a spolu s nimi je možné zavést atomy boru do určitých molekul za účelem získání dalších derivátů s novými vlastnostmi..
Insekticid
Pevná směs s kyselinou boritou, BdvaNEBO3-B (OH)3, představuje vzorec, který se používá jako domácí insekticid.
Rozpouštědlo pro oxidy kovů: tvorba skla, keramiky a slitin boru
Kapalný oxid boritý je schopen rozpouštět oxidy kovů. Z této výsledné směsi se po ochlazení získají pevné látky složené z boru a kovů..
V závislosti na množství BdvaNEBO3 použitá, stejně jako technika a typ oxidu kovu lze získat bohatou škálu skel (borosilikáty), keramiku (nitridy a karbidy boru) a slitiny (pokud se použijí pouze kovy).
Sklo nebo keramika obecně získávají větší odolnost a pevnost a také větší trvanlivost. V případě brýlí se nakonec používají pro optické a dalekohledové čočky a pro elektronická zařízení..
Pořadač
Při konstrukci ocelových tavicích pecí se používají žáruvzdorné cihly na bázi hořčíku. Oxid boritý se používá jako pojivo, které pomáhá držet je pevně pohromadě..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Oxid boritý. Obnoveno z: en.wikipedia.org
- PubChem. (2019). Oxid boritý. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Rio Tinto. (2019). Oxid boritý. 20 Mule Team Borax. Obnoveno z: borax.com
- A. Mukhanov, O. O. Kurakevich a V. L. Solozhenko. (s.f.). O tvrdosti oxidu boritého. LPMTMCNRS, Université Paris Nord, Villetaneuse, Francie.
- Hansen T. (2015). BdvaNEBO3 (Oxid boritý). Obnoveno z: digitalfire.com



Zatím žádné komentáře