
Co jsou to dipólové dipólové síly?
The dipólové dipólové síly nebo Keesomovy síly jsou intermolekulární interakce přítomné v molekulách s trvalými dipólovými momenty. Je to jedna z Van der Waalsových sil, ai když zdaleka není nejsilnější, je to klíčový faktor, který vysvětluje fyzikální vlastnosti mnoha sloučenin..
Termín „dipól“ výslovně označuje dva póly: jeden negativní a jeden pozitivní. Mluvíme tedy o dipolárních molekulách, když mají definované oblasti s vysokou a nízkou hustotou elektronů, což je možné pouze tehdy, když elektrony přednostně „migrují“ na určité atomy: nejvíce elektronegativní..
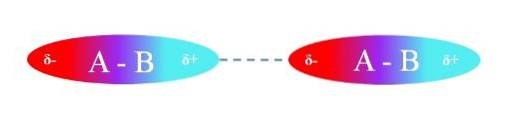
Horní obrázek ilustruje interakce dipól-dipól mezi dvěma molekulami A-B s permanentními dipólovými momenty. Podobně lze pozorovat, jak jsou molekuly orientovány tak, aby interakce byly účinné. Pozitivní oblast δ + tedy přitahuje negativní oblast δ-.
Podle výše uvedeného lze určit, že tyto typy interakcí jsou směrové (na rozdíl od interakcí iontový náboj - náboj). Molekuly v jejich prostředí orientují své póly takovým způsobem, že i když jsou slabé, součet všech těchto interakcí dává sloučenině skvělou intermolekulární stabilitu..
To má za následek, že sloučeniny (organické nebo anorganické) schopné vytvářet interakce dipól-dipól vykazují vysoké teploty varu nebo teploty tání..
Rejstřík článků
- 1 Dipólový moment
- 1.1 Symetrie
- 1.2 Asymetrie v nelineárních molekulách
- 2 Orientace dipólů
- 3 Interakce vodíkovými vazbami
- 4 Odkazy
Dipólový moment
Dipólový moment µ molekuly je vektorová veličina. Jinými slovy: záleží na směrech, kde je gradient polarity. Jak a proč vzniká tento gradient? Odpověď spočívá ve vazbách a v přirozené povaze atomů prvků..
Například v horním obrázku je A více elektronegativní než B, takže ve vazbě A-B je nejvyšší hustota elektronů umístěna kolem A.
Na druhou stranu se B „vzdá“ svého elektronového mraku, a proto je obklopeno oblastí chudou na elektrony. Tento rozdíl v elektronegativitách mezi A a B vytváří gradient polarity.
Jelikož jedna oblast je bohatá na elektrony (δ-), zatímco druhá oblast je chudá na elektrony (δ +), objevují se dva póly, které v závislosti na vzdálenostech mezi nimi vytvářejí různé velikosti μ, které jsou stanoveny pro každou sloučeninu.
Symetrie
Pokud má molekula určité sloučeniny µ = 0, pak se říká, že je to nepolární molekula (i když má gradienty polarity).
Abychom pochopili, jak symetrie - a tedy molekulární geometrie - hraje v tomto parametru důležitou roli, je nutné znovu zvážit vazbu A-B..
Kvůli rozdílu v jejich elektronegativitách existují definované oblasti bohaté a chudé na elektrony.
Co kdyby byly odkazy A-A nebo B-B? V těchto molekulách by nebyl žádný dipólový moment, protože oba atomy přitahují k nim stejným způsobem elektrony vazby (stoprocentní kovalentní vazba).
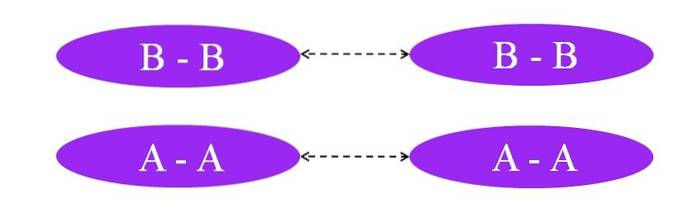
Jak je vidět na obrázku, ani v molekule A-A, ani v molekule B-B nejsou nyní oblasti bohaté nebo chudé na elektrony (červená a modrá). Zde je za udržování pohromadě A zodpovědný jiný typ sílydva a Bdva: indukované interakce dipól-dipól, známé také jako londýnské síly nebo rozptylové síly.
Naopak, pokud by molekuly byly typu AOA nebo BOB, došlo by k odpuzování mezi jejich póly, protože mají stejné náboje:
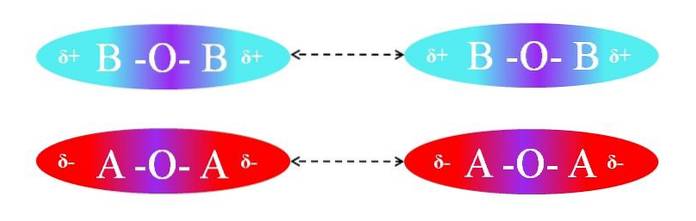
Oblasti δ + dvou molekul BOB neumožňují účinnou interakci dipól-dipól; totéž platí pro δ- oblasti dvou molekul AOA. Podobně mají oba páry molekul µ = 0. Gradient polarity O-A je vektorově zrušen s polaritou A-O vazby.
V důsledku toho se disperzní síly dostávají do hry také v páru AOA a BOB kvůli absenci efektivní orientace dipólů.
Asymetrie v nelineárních molekulách
Nejjednodušší je případ molekuly CF.4 (nebo zadejte CX4). Zde má C čtyřboký molekulární geometrii a oblasti bohaté na elektrony jsou ve vrcholech, konkrétně na elektronegativních atomech F.
Gradient polarity C-F se ruší v kterémkoli ze směrů čtyřstěnu, což způsobí, že vektorový součet všech se rovná 0.
Ačkoli je tedy střed čtyřstěnu velmi pozitivní (δ +) a jeho vrcholy velmi negativní (δ-), nemůže tato molekula vytvářet interakce dipól-dipól s jinými molekulami..
Orientace dipólů
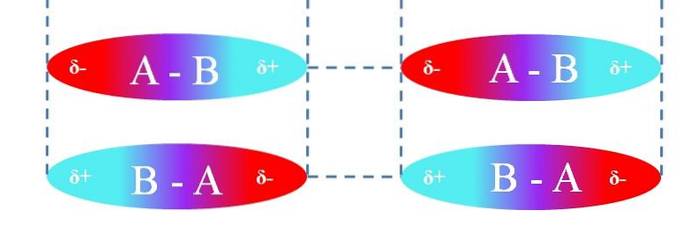
V případě lineárních molekul A-B jsou orientovány takovým způsobem, že tvoří nejúčinnější interakce dipól-dipól (jak je vidět na obrázku výše). Výše uvedené je použitelné stejným způsobem pro jiné molekulární geometrie; například ty úhlové v případě molekul NOdva.
Tyto interakce tedy určují, zda je sloučenina A-B při teplotě místnosti plyn, kapalina nebo pevná látka..
V případě sloučenin Adva a Bdva (ty z fialových elips), je velmi pravděpodobné, že jsou plynné. Pokud jsou však jeho atomy velmi objemné a snadno polarizovatelné (což zvyšuje Londýnské síly), pak mohou být obě sloučeniny buď pevné, nebo kapalné..
Čím silnější jsou interakce dipól-dipól, tím větší je soudržnost mezi molekulami; podobně, čím vyšší jsou teploty tání a varu sloučeniny. Je to proto, že k „rozbití“ těchto interakcí jsou zapotřebí vyšší teploty..
Na druhé straně zvýšení teploty způsobí, že molekuly vibrují, rotují a pohybují se častěji. Toto „molekulární míchání“ zhoršuje orientaci dipólů, a proto jsou oslabeny mezimolekulární síly sloučeniny..
Interakce vodíkové vazby
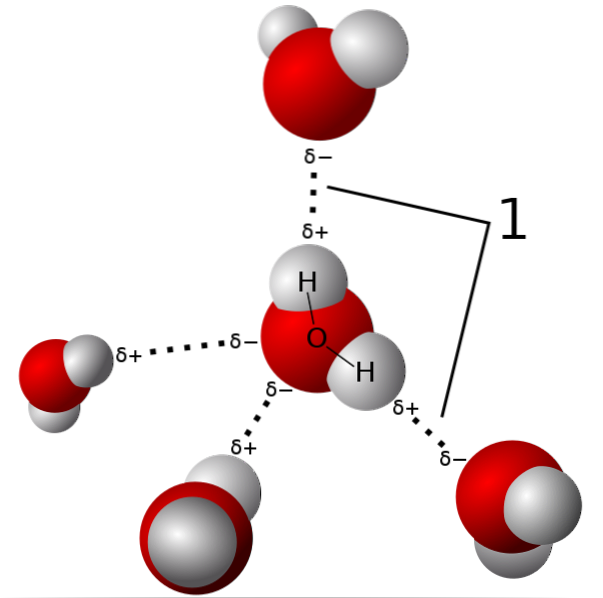
Na výše uvedeném obrázku je znázorněno pět molekul vody, které interagují vodíkovými vazbami. Jedná se o speciální typ interakcí dipól-dipól. Oblast chudá na elektrony je obsazena H; a oblast bohatá na elektrony (δ-) je obsazena vysoce elektronegativními atomy N, O a F.
To znamená, že molekuly s atomy N, O a F navázanými na H mohou tvořit vodíkové vazby..
Vodíkové vazby jsou tedy O-H-O, N-H-N a F-H-F, O-H-N, N-H-O atd. Tyto molekuly mají trvalé a velmi intenzivní dipólové momenty, které je správně orientují, aby „využily“ těchto mostů..
Jsou energeticky slabší než jakákoli kovalentní nebo iontová vazba. Součet všech vodíkových vazeb ve fázi sloučeniny (pevné, kapalné nebo plynné) z ní činí vlastnosti, které ji definují jako jedinečnou..
Tak je tomu například v případě vody, jejíž vodíkové vazby jsou odpovědné za vysokou teplotu varu a za to, že jsou v ledovém stavu méně husté než kapalná voda; důvod, proč se ledovce vznášejí v mořích.
Reference
- Dipole-Dipole Forces. Citováno dne 30. května 2018 z: chem.purdue.edu
- Neomezené učení. Dipole-Dipole Force. Citováno dne 30. května 2018 z: courses.lumenlearning.com
- Jennifer Roushar. (2016). Dipole-Dipole Forces. Citováno dne 30. května 2018 z: sophia.org
- Helmenstine, Anne Marie, Ph.D. (3. května 2018). Jaké jsou příklady vazby vodíku? Citováno dne 30. května 2018 z webu: thoughtco.com
- Mathews, C. K., Van Holde, K.E. a Ahern, K.G. (2002) Biochemistry. Třetí edice. Addison Wesley Longman, Inc., strana 33.
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 450-452.
- Uživatel Qwerter. (16. dubna 2011). 3D model vodíkových vazeb v toaletě. [Postava]. Citováno dne 30. května 2018 z: commons.wikimedia.org



Zatím žádné komentáře