
Historie jódu, vlastnosti, struktura, získávání, rizika, použití
The jód Jedná se o reaktivní nekovový prvek, který patří do skupiny 17 periodické tabulky (halogeny) a je reprezentován chemickým symbolem I. V podstatě je to docela populární prvek, od jodizované vody po hormon tyrosin.
V pevném stavu je jód tmavě šedý s kovovým leskem (spodní obrázek), schopný sublimovat za vzniku fialové páry, která po kondenzaci na studeném povrchu zanechává tmavý zbytek. Četné a atraktivní byly experimenty k prokázání těchto charakteristik.

Tento prvek izoloval poprvé Bernard Curtois v roce 1811, přičemž získal sloučeniny, které sloužily jako surovina pro výrobu ledku. Curtois však neidentifikoval jód jako prvek, což je zásluha sdílená Josephem Gay-Lussacem a Humphrym Davym. Gay-Lussac identifikoval prvek jako „jódu“, což je termín pocházející z řeckého slova „ioides“, kterým byla označena fialová barva..
Elementární jód, stejně jako ostatní halogeny, je diatomická molekula, složená ze dvou atomů jodu spojených kovalentní vazbou. Van der Waalsova interakce mezi molekulami jódu je nejsilnější mezi halogeny. To vysvětluje, proč je jod halogen s nejvyšší teplotou tání a teplotou varu. Kromě toho je to nejméně reaktivní z halogenů a ten s nejnižší elektronegativitou..
Jód je základním prvkem, který je třeba přijímat, protože je nezbytný pro růst těla; mozek a duševní vývoj; metabolismus obecně atd., doporučující denní příjem 110 µg / den.
Nedostatek jódu ve stavu plodu člověka je spojen s výskytem kretinismu, což je stav charakterizovaný zpomalením růstu těla; stejně jako nedostatečný duševní a intelektuální vývoj, strabismus atd..
Mezitím je nedostatek jódu v jakémkoli věku jedince spojen s výskytem strumy, charakterizované hypertrofií štítné žlázy. Struma je endemické onemocnění, protože se omezuje na určité zeměpisné oblasti s vlastními nutričními vlastnostmi.
Rejstřík článků
- 1 Historie
- 1.1 Objev
- 1.2 Vznik jména
- 1.3 Historická použití
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Standardní atomová hmotnost
- 2.3 Atomové číslo (Z)
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota
- 2.7 Rozpustnost
- 2,8 Zápach
- 2,9 Rozdělovací koeficient oktanol / voda
- 2.10 Rozklad
- 2.11 Viskozita
- 2.12 Trojitý bod
- 2.13 Kritický bod
- 2.14 Fúzní teplo
- 2.15 Odpařovací teplo
- 2.16 Molární tepelná kapacita
- 2.17 Tlak par
- 2.18 oxidační čísla
- 2.19 Elektronegativita
- 2.20 Ionizační energie
- 2.21 Tepelná vodivost
- 2.22 Elektrický odpor
- 2.23 Magnetický řád
- 2.24 Reaktivita
- 3 Struktura a elektronická konfigurace
- 3.1 - Jódový atom a jeho vazby
- 3.2 - Krystaly
- 3.3 - Fáze
- 4 Kde najít a získat
- 4.1 Kalich
- 4.2 Solanka
- 5 Biologická role
- 5.1 - Doporučená strava
- 5.2 - Hormony štítné žlázy
- 5.3 - Nedostatek
- 6 Rizika
- 7 použití
- 7.1 Lékaři
- 7.2 Reakce a katalytické působení
- 7.3 Fotografie a optika
- 7.4 Jiná použití
- 8 Reference
Příběh
Objev
Jód byl objeven francouzským chemikem Bernardem Curtoisem v roce 1811 při práci se svým otcem při výrobě ledku a vyžadoval k tomu uhličitan sodný..
Tato sloučenina byla izolována z mořských řas, které shromažďovali u pobřeží Normandie a Bretaně. Za tímto účelem byly řasy spáleny a popel byl promyt vodou, čímž byly výsledné zbytky zničeny přidáním kyseliny sírové..
Při jedné příležitosti, snad náhodou, Curtois přidal přebytek kyseliny sírové a vytvořila se fialová pára, která krystalizovala na studených površích a usazovala se jako tmavé krystaly. Curtois měl podezření, že je v přítomnosti nového prvku, a nazval jej „Substance X“.
Curtois objevil, že tato látka ve směsi s amoniakem vytvořila hnědou pevnou látku (trijodid dusíku), která explodovala při nejmenším kontaktu.
Curtois však měl omezení, aby ve svém výzkumu pokračoval, a rozhodl se předat vzorky své látky Charlesovi Desormesovi, Nicolasovi Clémentovi, Josephovi Gay-Lussacovi a André-Marie Ampèrovi, aby získali jejich spolupráci..
Vznik jména
V listopadu 1813 zveřejnili Desormes a Clément Curtoisův objev na veřejnosti. V prosinci téhož roku Gay-Lussac poukázal na to, že novou látkou by mohl být nový prvek, což naznačuje název „iode“ z řeckého slova „ioides“, označený jako fialový..
Sir Humphry Davy, který obdržel část vzorku věnovaného Ampèrovi Curtoisem, experimentoval se vzorkem a zaznamenal podobnost s chlorem. V prosinci 1813 se Royal Society of London podílela na identifikaci nového prvku.
Ačkoli mezi Gay-Lussacem a Davym proběhla diskuse o identifikaci jódu, oba uznali, že Curtois byl první, kdo jej izoloval. V roce 1839 Curtois konečně obdržel Montynovu cenu od Královské akademie věd jako uznání izolace jódu..
Historické využití
V 1839, Louis Daguerre dal jodu jeho první komerční použití, vynalezl způsob pro výrobu fotografických obrazů volal daguerreotypes, na tenkých plechech kovu..
V roce 1905 zkoumal americký patolog David Marine nedostatek jódu u některých nemocí a doporučil jeho příjem.
Fyzikální a chemické vlastnosti
Vzhled

Plná tmavě šedá s kovovým leskem. Při sublimaci jsou jeho páry fialové barvy (horní obrázek).
Standardní atomová hmotnost
126 904 u
Atomové číslo (Z)
53
Bod tání
113,7 ° C
Bod varu
184,3 ° C
Hustota
Okolní teplota: 4 933 g / cm3
Rozpustnost
Rozpouští se ve vodě za vzniku hnědých roztoků o koncentraci 0,03% při 20 ° C..
Tato rozpustnost se značně zvýší, pokud existují dříve rozpuštěné jodidové ionty, protože mezi I- a jádva za vzniku aniontových druhů I3-, který solvátuje lépe než jód.
V organických rozpouštědlech, jako je chloroform, tetrachlormethan a sirouhlík, se jod rozpouští a poskytuje fialový odstín. Podobně se rozpouští v dusíkatých sloučeninách, jako je pyridin, chinolin a amoniak, za vzniku hnědého roztoku, opět.
Rozdíl v zabarvení spočívá ve skutečnosti, že jód je rozpuštěn jako solvatované molekuly Idva, nebo jako komplexy pro přepravu nákladu; ty druhé se objevují, když jsou to polární rozpouštědla (voda mezi nimi), která se chovají jako Lewisovy báze tím, že darují elektrony jodu.
Zápach
Štiplavý, dráždivý a charakteristický. Prahová hodnota zápachu: 90 mg / m3 a prahová hodnota dráždivého zápachu: 20 mg / m3.
Rozdělovací koeficient oktanol / voda
Log P = 2,49
Rozklad
Při zahřátí na rozklad vydává kouř z jodovodíku a různých jodidových sloučenin..
Viskozita
2,27 cP při 116 ° C
Trojitý bod
386,65 K a 121 kPa
Kritický bod
819 K a 11,7 MPa
Teplo fúze
15,52 kJ / mol
Odpařovací teplo
41,57 kJ / mol
Molární tepelná kapacita
54,44 J / (mol K)
Tlak páry
Jód má mírný tlak par a při otevření nádoby pomalu sublimuje na fialovou páru, dráždí oči, nos a hrdlo..
Oxidační čísla
Oxidační čísla pro jód jsou: -1 (I.-), +1 (I.+), +3 (I.3+), +4 (I.4+), +5 (I.5+), +6 (I.6+) a +7 (I.7+). Ve všech jodidových solích, jako v případě KI, má jod oxidační číslo -1, protože v nich máme anion I-.
Jód získává kladná oxidační čísla, když je kombinován s prvky elektronegativnějšími než ony; například v jeho oxidech (I.dvaNEBO5 a já4NEBO9) nebo interhalogenované sloučeniny (I-F, I-Cl a I-Br).
Elektronegativita
2,66 na Paulingově stupnici
Ionizační energie
První: 1 008,4 kJ / mol
Za druhé: 1 845 kJ / mol
Za třetí: 3180 KJ / mol
Tepelná vodivost
0,449 W / (m K)
Elektrický odpor
1,39 107 Ω · m při 0 ° C
Magnetický řád
Diamagnetický
Reaktivita
Jód se kombinuje s většinou kovů za vzniku jodidů a také s nekovovými prvky, jako je fosfor a další halogeny. Jodidový iont je silné redukční činidlo, které spontánně uvolňuje elektron. Oxidací jodidu vzniká nahnědlý odstín jódu.
Jód je na rozdíl od jodidu slabé oxidační činidlo; slabší než brom, chlor a fluor.
Jód s oxidačním číslem +1 se může kombinovat s jinými halogeny s oxidačním číslem -1 za vzniku halogenidů jodu; například: jodbromid, IBr. Podobně se slučuje s vodíkem za vzniku jodovodíku, který se po rozpuštění ve vodě nazývá kyselina jodovodíková..
Kyselina jodovodíková je velmi silná kyselina schopná tvořit jodidy reakcí s kovy nebo jejich oxidy, hydroxidy a uhličitany. Jód má v kyselině jodové oxidační stav +5 (HIO3), který je dehydratován za vzniku oxidu jodičitého (I.dvaNEBO5).
Struktura a elektronická konfigurace
- Atom jódu a jeho vazby

Jód v základním stavu se skládá z atomu, který má sedm valenčních elektronů, pouze jeden je schopen dokončit svůj oktet a stát se izoelektronickým s xenonem vzácného plynu. Těchto sedm elektronů je uspořádáno na svých 5s a 5p orbitálech podle jejich elektronické konfigurace:
[Kr] 4d10 5 sdva 5 str5
Proto mají atomy I silnou tendenci kovalentně se spojovat, takže každý jednotlivě má ve své nejvzdálenější skořápce osm elektronů. Dva atomy I se tedy přiblíží a vytvoří vazbu I-I, která definuje dvojatomovou molekulu I.dva (horní obrázek); molekulární jednotka jódu ve třech fyzikálních stavech za normálních podmínek.
Obrázek ukazuje molekulu I.dva představuje model prostorového plnění. Není to jen diatomická molekula, ale také homonukleární a nepolární; takže jejich intermolekulární interakce (I.dva - Jádva) se řídí londýnskými disperzními silami, které jsou přímo úměrné jejich molekulové hmotnosti a velikosti atomů.
Tato vazba I-I je však slabší ve srovnání s vazbou ostatních halogenů (F-F, Cl-Cl a Br-Br). To je teoreticky způsobeno špatným překrytím jejich sp hybridních orbitalů3.
- Krystaly
Molekulová hmotnost I.dva umožňuje, aby jeho disperzní síly byly směrové a dostatečně silné, aby vytvořily ortorombický krystal při okolním tlaku. Jeho vysoký obsah elektronů způsobuje, že světlo podporuje nekonečné energetické přechody, což způsobuje, že krystaly jódu zbarvují černě.
Když však jód sublimuje, jeho páry vykazují fialové zbarvení. To již naznačuje specifičtější přechod uvnitř molekulárních orbitalů Idva (ti s nejvyšší energií nebo anti-link).
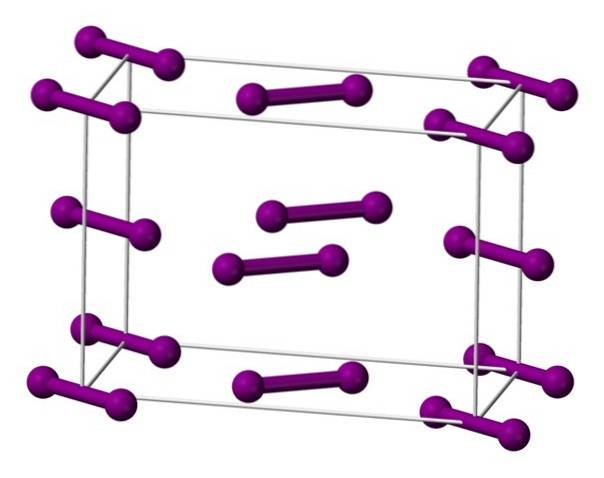
Molekuly I jsou zobrazeny výšedva, představovaný modelem koulí a prutů, uspořádaných v ortorombické jednotkové buňce.
Je vidět, že existují dvě vrstvy: spodní s pěti molekulami a střední se čtyřmi. Všimněte si také, že molekula jódu sedí na základně buňky. Sklo se vyrábí pravidelným rozdělením těchto vrstev ve všech třech rozměrech..
Cestou ve směru rovnoběžném s vazbami I-I se zjistilo, že jodové orbitaly se překrývají a vytvářejí vodivé pásmo, které z tohoto prvku dělá polovodič; jeho schopnost vést elektřinu však zmizí, pokud je sledován směr kolmý k vrstvám.
Spojovací vzdálenosti
Zdá se, že se odkaz I-I rozšířil; a ve skutečnosti to je, protože délka jeho vazby se zvyšuje z 266 hodin (plynný stav), na 272 hodin (pevný stav).
To může být způsobeno skutečností, že v plynu molekuly Idva jsou velmi daleko od sebe a jejich mezimolekulární síly jsou téměř zanedbatelné; zatímco v pevné látce se tyto síly (I-I - I-I) stávají hmatatelnými, přitahují atomy jódu dvou sousedních molekul k sobě a následně zkracují mezimolekulární vzdálenost (nebo interatomickou, viděno jiným způsobem).
Poté, když jodový krystal sublimuje, se vazba I-I smršťuje v plynné fázi, protože sousední molekuly již nevyvíjejí stejnou (disperzní) přitažlivou sílu na své okolí. A také logicky vzdálenost Idva - Jádva zvyšuje.
- Fáze
Již bylo zmíněno, že vazba I-I je ve srovnání s ostatními halogeny slabší. V plynné fázi při teplotě 575 ° C 1% molekul Idva rozpadají se na jednotlivé atomy I. Je tu tolik tepelné energie, že jen dva, které jsem opět spojil, se rozdělí atd.
Podobně k tomuto rozbití vazby může dojít, pokud je na krystaly jodu aplikován enormní tlak. Jeho přílišným stlačením (pod tlakem stotisíckrát vyšším než atmosférickým) molekuly Idva jsou přeskupeny jako monatomová fáze I a o jódu se pak říká, že vykazuje kovové vlastnosti.
Existují však i jiné krystalické fáze, například: ortorombická (centrovaná na tělo) (fáze II), tetragonální (centrovaná na tělo) (fáze III) a kubická (centrovaná na tvář).
Kde najít a získat
Jód má v poměru k zemské kůře hmotnostní poměr 0,46 ppm, což v něm zaujímá 61. místo. Jodidové minerály jsou vzácné a komerčně využitelnými ložisky jódu jsou jodičnany..
Jódové minerály se vyskytují v vyvřelých horninách s koncentrací 0,02 mg / kg až 1,2 mg / kg a v magmatických horninách s koncentrací 0,02 mg až 1,9 mg / kg. Lze jej také najít v Kimmeridgeské břidlici o koncentraci 17 mg / kg hmotnosti.
Dále se jodové minerály nacházejí ve fosfátových horninách s koncentrací v rozmezí od 0,8 do 130 mg / kg. Mořská voda má koncentraci jódu, která se pohybuje od 0,1 do 18 µg / l. Hlavními zdroji jódu byly dříve mořské řasy, houby a ústřice.
V současné době jsou však hlavními zdroji kalich, ložiska dusičnanu sodného v poušti Atacama (Chile) a solanky, zejména z japonského plynového pole v Minami Kanto východně od Tokia a z plynového pole Anadarko. Povodí v Oklahomě (USA).
Kalich
Jód se extrahuje z kalichu ve formě jodičnanu a zpracuje se hydrogensiřičitanem sodným, aby se snížil na jodid. Roztok se poté nechá reagovat s čerstvě extrahovaným jodičnanem, aby se usnadnila jeho filtrace. Caliche byl hlavním zdrojem jódu v 19. a na počátku 20. století..
Solanka
Po čištění se solanka zpracuje s kyselinou sírovou, která produkuje jodid..
Tento jodidový roztok se následně nechá reagovat s chlorem za vzniku zředěného jodového roztoku, který se odpaří proudem vzduchu, který je odváděn do absorpční věže oxidu siřičitého, přičemž dojde k následující reakci:
Jádva + 2 hdvaO + SOdva => 2 HI + HdvaSW4
Následně plynný jodovodík reaguje s chlorem za uvolnění jódu v plynném stavu:
2 HI + Cldva => Jádva + 2 HCl
A nakonec je jód filtrován, čištěn a zabalen pro použití..
Biologická role
- Doporučená strava
Jód je podstatným prvkem, protože zasahuje do mnoha funkcí u živých bytostí, které jsou zvláště známé u lidí. Jediným způsobem, jak se jód může dostat do člověka, je jídlo, které jí.
Doporučená strava pro jód se mění s věkem. Šestiměsíční dítě tedy vyžaduje příjem 110 µg / den; ale od 14 let je doporučená strava 150 µg / den. Kromě toho se uvádí, že příjem jódu by neměl překročit 1100 µg / den.
- Hormony štítné žlázy
Hormon stimulující štítnou žlázu (TSH) je vylučován hypofýzou a stimuluje příjem jódu folikuly štítné žlázy. Jód se přenáší do folikulů štítné žlázy, známých jako koloidy, kde se váže na aminokyselinu tyrosin za vzniku monoiodotyrosinu a diiodotyrosinu..
Ve folikulárním koloidu se molekula monojodtyroninu spojuje s molekulou dijodtyroninu za vzniku molekuly zvané trijodtyronin (T3). Na druhou stranu se mohou spojit dvě molekuly diiodotyrosinu, které tvoří tetraiodothyronin (T4). T3 a T4 se nazývají hormony štítné žlázy.
T hormony3 a T4 jsou vylučovány do plazmy, kde se váží na plazmatické proteiny; včetně transportního proteinu hormonu štítné žlázy (TBG). Většina hormonů štítné žlázy je transportována v plazmě jako T4.
Aktivní formou hormonů štítné žlázy je však T.3, takže T4 v „bílých orgánech“ hormonů štítné žlázy prochází odjodňováním a transformuje se na T3 uplatňovat své hormonální působení.
Efekty upravit
Účinky působení hormonů štítné žlázy jsou četné, lze poukázat na následující: zvýšený metabolismus a syntézu bílkovin; podpora růstu těla a rozvoje mozku; zvýšený krevní tlak a srdeční frekvence atd..
- Nedostatek
Nedostatek jódu, a tedy i hormonů štítné žlázy, známý jako hypotyreóza, má řadu důsledků, které jsou ovlivněny věkem člověka.
Pokud dojde k nedostatku jódu během fetálního stavu člověka, nejdůležitějším důsledkem je kretinismus. Tento stav je charakterizován známkami, jako je zhoršená duševní funkce, opožděný fyzický vývoj, strabismus a opožděné sexuální zrání..
Nedostatek jódu může způsobit strumu bez ohledu na věk, ve kterém k nedostatku dochází. Struma je nadměrný vývoj štítné žlázy způsobený nadměrnou stimulací žlázy hormonem TSH, uvolňovaným z hypofýzy v důsledku nedostatku jódu..
Nadměrná velikost štítné žlázy (struma) může stlačit průdušnici a omezit průchod vzduchu skrz ni. Kromě toho může způsobit poškození hrtanových nervů, které může vést k chrapotu..
Rizika
Otrava způsobená nadměrným příjmem jódu může způsobit popáleniny v ústech, krku a horečku. Také bolesti břicha, nevolnost, zvracení, průjem, slabý puls a kóma.
Přebytek jódu vyvolává některé z příznaků pozorovaných při nedostatku: dochází k inhibici syntézy hormonů štítné žlázy, což zvyšuje uvolňování TSH, což vede k hypertrofii štítné žlázy; tj. struma.
Existují studie, které naznačují, že nadměrný příjem jódu může způsobit tyroiditidu a papilární rakovinu štítné žlázy. Nadměrný příjem jódu může navíc interagovat s léky, což omezuje jejich účinek..
Nadměrný příjem jódu ve spojení s antityroidními léky, jako je methimazol, používaný k léčbě hypertyreózy, může mít aditivní účinek a způsobit hypotyreózu..
Inhibitory angiotenzin konvertujícího enzymu (ACE), jako je benazepril, se používají k léčbě hypertenze. Užívání příliš velkého množství jodidu draselného zvyšuje riziko hyperkalemie a hypertenze.
Aplikace
Lékaři
Jód působí jako dezinfekční prostředek na kůži nebo rány. Má téměř okamžitý antimikrobiální účinek, proniká dovnitř mikroorganismů a interaguje s aminokyselinami síry, nukleotidy a mastnými kyselinami, což způsobuje buněčnou smrt.
Vyvíjí své antivirové působení hlavně na kryté viry, předpokládá, že útočí na proteiny na povrchu krytých virů..
Jodid draselný ve formě koncentrovaného roztoku se používá při léčbě tyreotoxikózy. Používá se také ke kontrole účinků záření z 131I blokováním vazby radioaktivního izotopu na štítnou žlázu.
Jód se používá k léčbě dendritické keratitidy. Za tímto účelem je rohovka vystavena vodním parám nasyceným jodem, což dočasně ztratí epitel rohovky; ale dojde k úplnému zotavení z něj za dva nebo tři dny.
Jód má také příznivé účinky při léčbě cystické fibrózy lidského prsu. Rovněž bylo zdůrazněno, že 131Mohl bych být volitelnou léčbou rakoviny štítné žlázy.
Reakce a katalytické působení
Jód se používá k detekci přítomnosti škrobu, který má modrý odstín. Reakce jódu se škrobem se také používá k detekci přítomnosti padělaných bankovek vytištěných na papíře obsahujícím škrob..
K detekci amoniaku se používá tetrajodmercurát draselný (II), známý také jako Nesslerovo činidlo. Podobně se v jodoformovém testu používá alkalický roztok jodu, aby se prokázala přítomnost methylketonů..
Anorganické jodidy se používají při čištění kovů, jako je titan, zirkon, hafnium a thorium. V jedné fázi procesu musí být vytvořeny tetrajodidy těchto kovů.
Jód slouží jako stabilizátor kalafuny, oleje a dalších dřevěných výrobků.
Jód se používá jako katalyzátor při reakcích organické syntézy methylace, izomerizace a dehydrogenace. Mezitím se kyselina jodovodíková používá jako katalyzátor pro výrobu kyseliny octové v procesech Monsanto a Cativa..
Jód působí jako katalyzátor při kondenzaci a alkylaci aromatických aminů, jakož i při sulfatačních a sulfanačních procesech a při výrobě syntetických kaučuků..
Fotografie a optika
Jodid stříbrný je nezbytnou součástí tradičního fotografického filmu. Jód se používá při výrobě elektronických nástrojů, jako jsou monokrystalické hranoly, polarizační optické nástroje a sklo schopné přenášet infračervené paprsky..
Jiná použití
Jód se používá při výrobě pesticidů, anilinových barviv a ftalinu. Kromě toho se používá při syntéze barviv a je hasivem. A konečně, jodid stříbrný slouží jako kondenzační jádro pro vodní páru v oblacích, aby způsobil déšť..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Stuart Ira Fox. (2003). Fyziologie člověka. První vydání. Upravit. McGraw-Hill Interamericana
- Wikipedia. (2019). Jód. Obnoveno z: en.wikipedia.org
- Takemura Kenichi, Sato Kyoko, Fujihisa Hiroshi a Onoda Mitsuko. (2003). Modulovaná struktura pevného jódu během jeho molekulární disociace za vysokého tlaku. Přírodní svazek 423, strany 971-974. doi.org/10.1038/nature01724
- Chen L. a kol. (1994). Strukturní fázové přechody jódu při vysokém tlaku. Fyzikální ústav, Academia Sinica, Peking. doi.org/10.1088/0256-307X/11/2/010
- Stefan Schneider a Karl Christe. (26. srpna 2019). Jód. Encyklopedie Britannica. Obnoveno z: britannica.com
- Dr. Doug Stewart. (2019). Fakta o prvcích jódu. Chemicool. Obnoveno z: chemicool.com
- Národní centrum pro biotechnologické informace. (2019). Jód. Databáze PubChem. CID = 807. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Rohner, F., Zimmermann, M., Jooste, P., Pandav, C., Caldwell, K., Raghavan, R., & Raiten, D. J. (2014). Biomarkery výživy pro vývoj - jódový přehled. The Journal of Nutrition, 144 (8), 1322S-1342S. doi: 10,3945 / jn.113.181974
- Advameg. (2019). Jód. Vysvětlení chemie. Obnoveno z: chemistryexplained.com
- Traci Pedersen. (19. dubna 2017). Fakta o jódu. Obnoveno z: livescience.com
- Megan Ware, RDN, LD. (30. května 2017). Vše, co potřebujete vědět o jódu. Obnoveno z: medicalnewstoday.com
- Národní institut zdraví. (9. července 2019). Jód. Obnoveno z: ods.od.nih.gov


Zatím žádné komentáře