
Struktura octanu sodného, vlastnosti, syntéza, použití

The octan sodný je sodná sůl kyseliny octové, jejíž molekulární vzorec je CdvaH3NEBOdvaNa. Skládá se z jemně bílého prášku, který je v zásadě přítomen ve dvou formách: bezvodý a trihydrát. Oba jsou velmi rozpustné ve vodě, univerzálním rozpouštědle; ale ne tak rozpustný v alkoholech nebo acetonu.
Bezvodá forma má hustotu, teplotu tání a teplotu varu s vyššími hodnotami, než jaké představuje trihydrát octanu sodného. Je to proto, že molekuly vody interferují mezi interakcemi iontů Na.+ a CH3VRKAT-.

Octan sodný je stabilní, zejména pokud je skladován při teplotě 2 až 8 ° C; ale je citlivý na působení silných oxidačních činidel a halogenů.
Může být připraven reakcí hydrogenuhličitanu sodného s kyselinou octovou. Rovněž s reakcí kyseliny octové s hydroxidem sodným. Obě reakce se dají snadno vyrobit a jsou levné; první lze dokonce udělat doma.
Tato sůl je málo toxická sloučenina. Produkuje podráždění pokožky, pouze po častém a nepřetržitém kontaktu. Je mírně dráždivý pro oči, ale může dráždit dýchací cesty. Neexistují žádné informace o škodlivých účincích požití..
Má mnoho použití a aplikací, přičemž zdůrazňuje svou funkci tlumení pH spolu s kyselinou octovou. Acetátový pufr má pKa = 4,7; což poskytuje vysokou účinnost regulace pH v kyselém prostředí s hodnotami pH mezi 3 a 6.
Vzhledem ke své nízké toxicitě a svým vlastnostem se široce používá k vylepšení chuti potravin, stejně jako prostředek, který poskytuje ochranu před znehodnocením díky působení proti mikrobům..
Rejstřík článků
- 1 Struktura octanu sodného
- 1.1 Hydratované krystaly
- 2 Vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Vzhled
- 2.4 Zápach
- 2.5 Hustota
- 2.6 Teplota tání
- 2.7 Bod varu
- 2.8 Rozpustnost
- 2.9 Kyselost
- 2.10 Zásaditost
- 2.11 Index lomu (ηD)
- 2.12 Kalorická kapacita
- 2.13 Bod vzplanutí
- 2.14 Teplota samovznícení
- 2,15 pH
- 2.16 Stabilita
- 2.17 Reakce
- 3 Syntéza
- 4 použití
- 4.1 Tepelné vaky
- 4.2 Průmyslové
- 4.3 Lékařské použití
- 4,4 pH pufrovací roztok
- 4.5 Výzkumné laboratoře
- 4.6 Konzervování potravin
- 4.7 Zachování betonu
- 5 Experimenty pro mladé lidi
- 5.1 Pokus 1
- 5.2 Pokus 2
- 6 Toxicita
- 7 Reference
Struktura octanu sodného
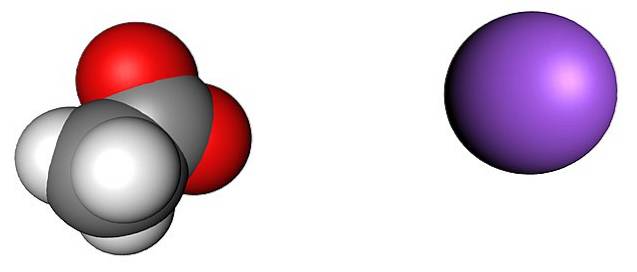
Obrázek výše ukazuje ionty, které tvoří krystaly bezvodého octanu sodného (bez vody). Fialová koule odpovídá kationtu Na+, a molekulární iont nalevo je acetát, CH3VRKAT-, s atomy kyslíku reprezentovanými červenými koulemi.
Tyto páry podle vzorce CH3COONa, jsou v poměru 1: 1; pro každý CH anion3VRKAT-, musí existovat Na kation+ přitahoval záporný náboj a naopak. Přitažlivost mezi nimi a odpuzování mezi stejnými náboji tedy končí vytvořením strukturních vzorů, které definují krystal, jehož minimální výraz je jednotková buňka.
Uvedená jednotková buňka, stejně jako krystal jako celek, se liší v závislosti na uspořádání iontů v prostoru; není to vždy stejné, dokonce ani pro stejný krystalický systém. Například bezvodý octan sodný může tvořit dva ortorombické polymorfy, z nichž jeden je znázorněn níže:
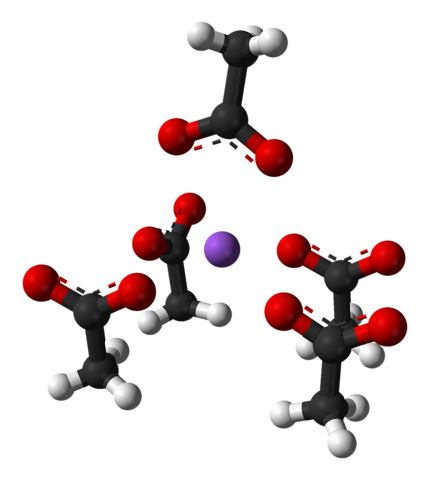
Všimněte si uspořádání iontů: čtyři ionty CH3VRKAT- zamknou Na+ takovým způsobem, že „nakreslí“ zkreslenou pyramidu čtvercového tvaru. Každý z těchto ch3VRKAT- zase interagují s jinou Na+ přilehlý.
Hydratované krystaly
Octan sodný má vysokou afinitu k vodě; ve skutečnosti je to lahůdkové, to znamená, že zadržuje vlhkost, dokud se v ní nerozpustí. Čím vyšší je vlhkost, tím dříve se „roztaje“. Je to proto, že oba CH3VRKAT- jako Na+ mohou hydratovat, obklopit se molekulami vody, které orientují své dipóly na své náboje (Na+ Achdva, CH3VRKAT- HOH).
Když se tato sůl připravuje v laboratoři nebo doma, její afinita k vodě je taková, že i za normálních teplot se již získává jako hydrát; CH3COONa 3HdvaO. Jeho krystaly přestávají být ortorombické a stávají se monoklinické, protože nyní obsahují tři molekuly vody pro každý pár CH3VRKAT- a Na+.
Vlastnosti
Jména
-Octan sodný.
-Ethanoát sodný (IUPAC).
Molární hmotnost
-Bezvodý: 82,03 g / mol.
-Trihydrát: 136,03 g / mol.
Vzhled
Průhledně bílý prášek.
Zápach
Do octa při zahřátí na rozklad.
Hustota
-Bezvodý: 1,528 g / cm3 při 20 ° C.
-Trihydrát: 1,45 g / cm3 při 20 ° C.
Bod tání
-Bezvodý: 324 ° C (615 ° F, 597 K).
-Trihydrát: 58 ° C (136 ° F, 331 K).
Bod varu
-Bezvodý: 881,4 ° C (1618,5 ° F, 1154,5 K).
-Trihydrát: 122 ° C (252 ° F, 395 K). Rozkládá se.
Rozpustnost
Ve vodě
-Bezvodý: 123,3 g / 100 ml při 20 ° C.
-Trihydrát: 46,4 g / 100 ml při 20 ° C.
V methanolu
16 g / 100 g při 15 ° C.
V ethanolu
5,3 g / 100 ml (trihydrát).
V acetonu
0,5 g / kg při 15 ° C.
Kyselost
pKa: 24 (20 ° C).
Zásaditost
pKb: 9,25. Zde je prokázáno, že octan sodný je zásaditá sůl, protože má pKb méně než jeho pKa.
Index lomu (ηD)
1464
Kalorická kapacita
-100,83 J / mol K (bezvodý).
-229,9 J / mol K (trihydrát).
bod vznícení
Nad 250 ° C.
Teplota samovznícení
600 ° C.
pH
8,9 (0,1 M roztok při 25 ° C).
Stabilita
Stabilní. Nekompatibilní se silnými oxidačními činidly a halogeny. Citlivý na vlhkost.
Reakce
Octan sodný může tvořit ester reakcí s alkylhalogenidem; například bromethan:
CH3COONa + BrCHdvaCH3 => CH3COOCHdvaCH3 + NaBr
Dekarboxyláty octanu sodného na methan (pyrolýza) v přítomnosti NaOH:
CH3COONa + NaOH => CH4 + NadvaCO3
Reakce je katalyzována solemi cesia.
Syntéza
Octan sodný lze v laboratoři levně vyrobit reakcí hydrogenuhličitanu sodného s kyselinou octovou:
NaHCO3 + CH3COOH => CH3COONa + HdvaCO3
Tato reakce je doprovázena přítomností intenzivního probublávání v roztoku v důsledku rozkladu kyseliny uhličité ve vodě a oxidu uhličitého..
HdvaCO3 => HdvaO + COdva
Průmyslově se octan sodný vyrábí reakcí kyseliny octové s hydroxidem sodným.
CH3COOH + NaOH => CH3COONa + HdvaNEBO
Aplikace
Tepelné vaky
Octan sodný se používá k výrobě tepelných vaků.
Nejprve se krystaly soli rozpustí v objemu vody, aby se připravil roztok, který se stane přesyceným..
Poté se roztok zahřeje na teplotu vyšší než 58 ° C, což je jeho teplota tání. Přesycený roztok se nechá ochladit na teplotu místnosti a tvorba krystalů není pozorována; roztok je podchlazený.
Absence krystalů je vysvětlena skutečností, že molekuly kapaliny jsou příliš neuspořádané a nemají správnou orientaci, aby dosáhly teploty krystalizace. Kapalina je v metastabilním stavu, stavu nerovnováhy.
Vzhledem k nestabilitě podchlazené kapaliny je jakékoli narušení dostatečné k zahájení krystalizace. V případě termálních vaků se lisuje mechanické připojení, aby se kapalina míchala a aby se zahájila tvorba krystalů a tuhnutí roztoku trihydrátu octanu sodného..
Jak dochází ke krystalizaci, teplota se zvyšuje. Krystaly trihydrátu octanu sodného získávají vzhled ledu, ale jsou horké, proto se mu říká „horký led“..
Průmyslový
-Octan sodný se používá v textilním průmyslu jako mořidlo v procesu barvení textilií
-Neutralizuje odpad kyseliny sírové
-Používá se při zpracování bavlny k výrobě vatových tamponů použitelných při osobním čištění a pro lékařské účely
-Používá se k moření kovů před jejich chromováním
-Spolupracuje tak, aby při výrobě syntetického kaučuku nedocházelo k vulkanizaci chloroprenu
-Zasahuje do čištění glukózy
-Používá se při činění kůže.
Lékařské použití
Octan sodný je jednou ze sloučenin používaných k dodávce elektrolytů podávaných pacientům intravenózně..
Používá se ke korekci hladin sodíku u pacientů s hyponatremií, také ke korekci metabolické acidózy a alkalizaci moči..
Pufrovací roztok PH
Používá se jako regulátor pH při mnoha enzymatických reakcích, ke kterým dochází mezi pH 3 a pH 6.
Různého pH octanového pufrovacího roztoku se dosáhne změnou koncentrace kyseliny octové a octanu sodného..
Tak například pro získání pH 4,5 má pufrovací roztok koncentraci kyseliny octové 3,8 g / la koncentraci bezvodého octanu sodného 3,0 g / l..
Koncentraci acetátového pufru lze zvýšit, přičemž se ve stejném poměru zvýší složky roztoku nezbytné k dosažení požadovaného pH.
Pufr acetát / acetonitril se používá při kapilární elektroforéze při separaci fotoberberinů.
Výzkumné laboratoře
-Octan sodný je slabé nukleofilní činidlo, které se používá při aniontové polymeraci β-laktonu.
-Používá se jako činidlo při nukleární magnetické rezonanci biologických makromolekul.
-Používá se při extrakci DNA z buněk. Sodík je kation, který interaguje s negativními náboji fosfátů přítomných v DNA, což pomáhá při jejich kondenzaci. V přítomnosti ethanolu vytvoří DNA sraženinu, která se pak může oddělit do vodné vrstvy.
Konzervace potravin
-Pomáhá předcházet růstu bakterií a navíc zabraňuje tvorbě nadměrné kyselosti, která způsobuje znehodnocení potravin, a tím udržuje specifické pH.
-Sodík obsažený v octanu zvyšuje chuť jídla.
-Octan sodný se používá při přípravě nakládané zeleniny: okurky, mrkve, cibule atd. Kromě toho se používá při konzervování masa.
Zachování betonu
Beton je poškozen působením vody, což zkracuje jeho trvání. Octan sodný působí jako betonové těsnící činidlo, díky kterému je vodotěsný a prodlužuje jeho původní vlastnosti.
Experimenty s mládeží
Experiment 1
Jednoduchým experimentem je syntéza octanu sodného reakcí hydrogenuhličitanu sodného s octem (5% kyselina octová).
30 ml octa se vloží do kádinky a přidá se přibližně 3,5 g hydrogenuhličitanu..
Při reakci se tvoří octan sodný a kyselina uhličitá. Kyselina se štěpí na oxid uhličitý a vodu. Tvorba oxidu uhličitého způsobí v roztoku intenzivní probublávání.
K zachycení octanu sodného se voda odpaří a roztok se zahřeje.
Experiment 2
Dalším jednoduchým experimentem je tvorba krystalů trihydrátu octanu sodného.
Za tímto účelem se zváží asi 20 g trihydrátu octanu sodného a vloží se do kádinky, poté se přidá 10 ml vody. Roztok se zahřeje na teplotu nad 58 ° C.
Octan sodný je zcela rozpuštěn, aby bylo zajištěno, že je roztok přesycený. Dříve byla Pietriho miska umístěna na studený povrch.
Obsah kádinky s trihydrátem acetátu se pomalu nalije do Pietriho misky. Teplota kapaliny v kapsli začíná klesat, dokonce pod teplotu tání, aniž by byla pozorována krystalizace nebo tuhnutí trihydrátu octanu sodného..
Obvykle za účelem krystalizace trihydrátu octanu sodného se přidá malé množství soli, která slouží jako krystalizační jádro. Jindy dochází k malému narušení roztoku, aby se zahájila krystalizace octanu sodného.
Krystaly trihydrátu octanu sodného mají vzhled ledu, ale pokud se jich dotknete, zjistíte, že jsou relativně horké. Z tohoto důvodu se sůl nazývá „horký led“..
Toxicita
Octan sodný je velmi málo toxická sloučenina. Rovněž není klasifikován jako senzibilizátor kůže a dýchacích cest..
Navíc není octan sodný klasifikován jako mutagenní, karcinogenní nebo reprodukční toxický prostředek pro zárodečné buňky..
Stručně řečeno, mírně dráždí oči. Po vdechnutí může dojít k podráždění dýchacích cest. Častý a stálý kontakt s pokožkou může způsobit podráždění.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- WorldOfChemicals. (16. ledna 2017). Jak připravit octan sodný doma? Obnoveno z: medium.com
- Národní centrum pro biotechnologické informace. (2019). Octan sodný. Databáze PubChem. CID = 517045. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- S. Cameron, K. M. Mannan a M. O. Rahman. (1976). Krystalová struktura trihydrátu octanu sodného. Acta Cryst. B32, 87.
- Wikipedia. (2019). Octan sodný. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (24. ledna 2019). Připravte horký led z octa a jedlé sody. Obnoveno z: thoughtco.com
- Chemická kniha. (2017). Octan sodný. Obnoveno z: chemicalbook.com
- Wasserman Robin. (2019). Použití octanu sodného. Obnoveno z: livestrong.com
- Drugbank. (2019). Octan sodný. Obnoveno z: drugbank.ca



Zatím žádné komentáře