
Struktura amfipatických molekul, charakteristiky, příklady
The amfipatické nebo amfifilní molekuly Jsou to ti, kteří mohou cítit afinitu nebo odpor současně pro určité rozpouštědlo. Rozpouštědla jsou chemicky klasifikována jako polární nebo nepolární; hydrofilní nebo hydrofobní. Tyto typy molekul tedy mohou vodu „milovat“, stejně jako ji „nenávidět“..
Podle předchozí definice existuje jen jeden způsob, jak to možné: tyto molekuly musí mít ve svých strukturách polární a nepolární oblasti; Buď jsou víceméně homogenně distribuovány (například u proteinů), nebo jsou heterogenně lokalizovány (v případě povrchově aktivních látek)

Povrchově aktivní látky, nazývané také detergenty, jsou snad nejznámějšími amfipatickými molekulami ze všech od nepaměti. Od té doby, co člověka uchvátila podivná fyziognomie bubliny, znepokojená přípravou mýdel a čisticích prostředků, znovu a znovu se setkává s fenoménem povrchového napětí.
Pozorování bubliny je stejné jako pozorování „pasti“, jejíž stěny, vytvořené vyrovnáním amfipatických molekul, zadržují plynný obsah vzduchu. Jeho sférické tvary jsou nejvíce matematicky a geometricky stabilní, protože snižují povrchové napětí rozhraní vzduch-voda na minimum..
To znamená, že byly diskutovány další dvě vlastnosti amfipatických molekul: mají tendenci se sdružovat nebo samy sestavovat a některé nižší povrchové napětí v kapalinách (ty, které to dokážou, se nazývají povrchově aktivní látky).
V důsledku vysoké tendence ke sdružování otevírají tyto molekuly pole morfologického (a dokonce i architektonického) studia svých nanoagregátů a supramolekul, které je tvoří; s cílem navrhnout sloučeniny, které lze funkcionalizovat a neměřitelnými způsoby interagovat s buňkami a jejich biochemickými matricemi.
Rejstřík článků
- 1 Struktura
- 1.1 Intermolekulární interakce
- 1.2 Různé
- 2 Charakteristika amfipatických molekul
- 2.1 Sdružení
- 2.2 Fyzické
- 3 příklady
- 4 Aplikace
- 4.1 Buněčné membrány
- 4.2 Dispergátory
- 4.3 Emulgátory
- 4.4 Čisticí prostředky
- 4.5 Antioxidanty
- 5 Reference
Struktura
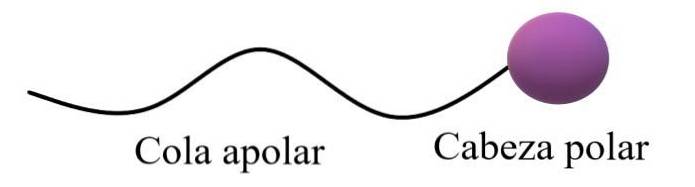
O amfifilních nebo amfipatických molekulách se říká, že mají polární oblast a nepolární oblast. Apolární oblast obvykle sestává z nasyceného nebo nenasyceného uhlíkového řetězce (s dvojnými nebo trojnými vazbami), který je reprezentován jako „nepolární ocas“; doprovázeno „polární hlavou“, ve které se nacházejí nejvíce elektronegativní atomy.
Horní obecná struktura ilustruje komentáře v předchozím odstavci. Polární hlava (fialová koule) mohou být funkční skupiny nebo aromatické kruhy, které mají trvalé dipólové momenty a jsou také schopné vytvářet vodíkové vazby. Proto by tam měl být umístěn nejvyšší obsah kyslíku a dusíku.
V této polární hlavě mohou být také iontové, záporné nebo kladné náboje (nebo obojí současně). Tato oblast vykazuje vysokou afinitu k vodě a dalším polárním rozpouštědlům..
Na druhou stranu, apolární ocas, vzhledem ke svým převládajícím CH vazbám, interaguje prostřednictvím londýnských rozptylových sil. Tato oblast je zodpovědná za to, že amfipatické molekuly také vykazují afinitu k tukům a nepolárním molekulám ve vzduchu (Ndva, COdva, Ar atd.).
V některých chemických textech je model horní struktury srovnáván s tvarem lízátka.
Intermolekulární interakce
Když amfipatická molekula přijde do kontaktu s polárním rozpouštědlem, řekněme vodou, její oblasti mají různé účinky na molekuly rozpouštědla..
Nejprve se molekuly vody snaží solvatovat nebo hydratovat polární hlavu a držet se stranou od apolárního ocasu. V tomto procesu se vytváří molekulární porucha.
Mezitím molekuly vody kolem apolárního ocasu mají sklon uspořádat se, jako by to byly malé krystaly, což jim umožňuje minimalizovat odpudivost. V tomto procesu je vytvořen molekulární řád.
Mezi poruchami a řády přijde okamžik, kdy se amfipatická molekula bude snažit o interakci s jinou, což povede k mnohem stabilnějšímu procesu.
Miscelas
K oběma bude přistupováno prostřednictvím jejich nepolárních ocasů nebo polárních hlav, a to takovým způsobem, že související oblasti budou interagovat jako první. To je stejné jako představa, že dva „fialové lízátka“ na obrázku výše se přibližují propletením jejich černých ocasů nebo spojením jejich dvou fialových hlav..
A tak začíná zajímavý asociační jev, ve kterém je několik z těchto molekul spojeno za sebou. Nejsou spojeny svévolně, ale podle řady strukturálních parametrů, které nakonec izolují apolární ocasy v jakémsi „nepolárním jádru“, přičemž polární hlavy jsou vystaveny jako polární skořápka..
Říká se tedy, že se zrodila sférická směsice. Během tvorby miscely však existuje přípravná fáze, která se skládá z lipidové dvojvrstvy. Tyto a další jsou některé z mnoha makrostruktur, které mohou amfifilní molekuly přijmout.
Charakteristika amfipatických molekul
Sdružení

Pokud jsou apolární ocasy brány jako černé jednotky a polární hlavy jako fialové jednotky, bude pochopeno, proč je na horním obrázku kůra miscela fialová a její jádro černé. Jádro je nepolární a jeho interakce s molekulami vody nebo rozpouštědla jsou nulové..
Pokud je naopak rozpouštědlo nebo médium nepolární, budou to odpuzování trpět polárními hlavami a následně budou umístěny ve středu směsi; to znamená, že je obrácená (A, spodní obrázek).
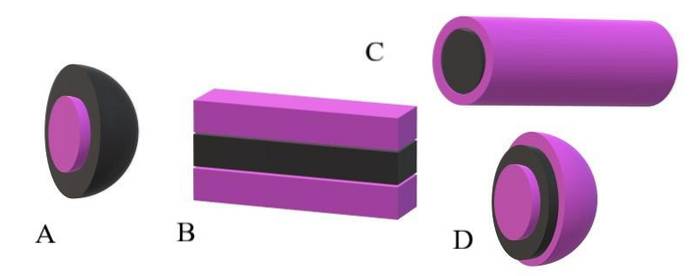
Je pozorováno, že obrácená miscela má černou nepolární skořápku a fialové polární jádro. Ale předtím, než se vytvoří miscelas, amfifilní molekuly se nalézají jednotlivě a mění pořadí molekul rozpouštědla. Zvýšená koncentrace, začnou se sdružovat ve struktuře jedné nebo dvou vrstev (B).
Z B se laminy začínají křivit a tvoří D, vezikul. Další možností, v závislosti na tvaru apolárního ocasu vzhledem k jeho polární hlavě, je to, že se spojí, aby vytvořily válcovou směsici (C).
Nanoagregáty a supramolekuly
Existuje tedy pět hlavních struktur, které odhalují základní charakteristiku těchto molekul: jejich vysokou tendenci se sdružovat a samy sestavovat do supramolekul, které agregují za vzniku nanoagregátů..
Amfifilní molekuly se tedy nenacházejí samotné, ale ve spojení..
Fyzický
Amfipatické molekuly mohou být neutrální nebo iontově nabité. Ti, kteří mají záporné náboje, mají v polární hlavě atom kyslíku se záporným formálním nábojem. Některé z těchto atomů kyslíku pocházejí z funkčních skupin, jako jsou: -COO-, -SW4-, -SW3- nebo -PO4-.
Pokud jde o kladné náboje, obvykle pocházejí z aminů, RNH3+.
Přítomnost nebo nepřítomnost těchto nábojů nemění skutečnost, že tyto molekuly obecně tvoří krystalické pevné látky; nebo pokud jsou relativně lehké, lze je najít jako oleje.
Příklady
Některé příklady amfipatických nebo amfifilních molekul budou uvedeny níže:
-Phofolipidy: fosfatidylethanolamin, sfingomyelin, fosfatidylserin, fosfatidylcholin.
-Cholesterol.
-Glykolipidy.
-Laurylsulfát sodný.
-Proteiny (jsou amfifilní, ale ne povrchově aktivní látky).
-Fenolické tuky: kardanol, kardoly a anakardiální kyseliny.
-Cetyltrimethylamoniumbromid.
-Mastné kyseliny: palmitová, linolová, olejová, laurová, stearová.
-Alkoholy s dlouhým řetězcem: 1-dodekanol a další.
-Amfifilní polymery: jako jsou ethoxylované fenolové pryskyřice.
Aplikace
Buněčné membrány
Jedním z nejdůležitějších důsledků schopnosti těchto molekul sdružovat se je to, že vytvářejí druh zdi: lipidová dvojvrstva (B).
Tato dvojvrstva se prodlužuje k ochraně a regulaci vstupu a výstupu sloučenin do buněk. Je dynamický, protože jeho apolární ocasy se otáčejí a pomáhají amfipatickým molekulám pohybovat se..
Podobně, když je tato membrána připevněna ke dvěma koncům, aby se měla svisle, slouží k měření její propustnosti; a tím jsou získána cenná data pro návrh biologických materiálů a syntetických membrán ze syntézy nových amfipatických molekul s různými strukturálními parametry..
Dispergátory
V ropném průmyslu se tyto molekuly a polymery z nich syntetizované používají k dispergaci asfaltenů. Těžiště této aplikace spočívá na hypotéze, že asfaltény sestávají z koloidní pevné látky s vysokou tendencí k flokulaci a usazování jako hnědočerné pevné látky, která způsobuje vážné ekonomické problémy..
Amfipatické molekuly pomáhají udržovat asfaltény rozptýlené po delší dobu tváří v tvář fyzikálně-chemickým změnám v surovém stavu..
Emulgátory
Tyto molekuly pomáhají smíchat dvě kapaliny, které by za běžných podmínek nebyly mísitelné. Například ve zmrzlinách pomáhají vodě a vzduchu tvořit část stejné pevné látky spolu s tukem. Mezi nejpoužívanější emulgátory pro tento účel patří emulgátory odvozené od jedlých mastných kyselin.
Čistící prostředky
Amfifilní charakter těchto molekul se používá k zachycování tuků nebo nepolárních nečistot, které mají být později odnášeny současně s polárním rozpouštědlem, jako je voda..
Stejně jako příklad bublin, kde byl zachycen vzduch, zachycují čisticí prostředky tuk ve svých micelách, které s polární skořápkou účinně interagují s vodou a odstraňují nečistoty..
Antioxidanty
Polární hlavy mají zásadní význam, protože definují mnohostranné využití, které tyto molekuly mohou mít v těle.
Pokud mají například sadu aromatických kruhů (včetně derivátů fenolového kruhu) a polárních kruhů schopných neutralizovat volné radikály, pak budou existovat amfifilní antioxidanty; a pokud také nemají toxické účinky, budou na trhu k dispozici nové antioxidanty.
Reference
- Alberts B, Johnson A, Lewis J a kol. (2002). Molekulární biologie buňky. 4. vydání. New York: Garland Science; Lipidová dvojvrstva. Obnoveno z: ncbi.nlm.nih.gov
- Jianhua Zhang. (2014). Amfifilní molekuly. Springer-Verlag Berlin Heidelberg, E. Droli, L. Giorno (eds.), Encyclopedia of Membranes, DOI 10.1007 / 978-3-642-40872-4_1789-1.
- Řekl Joseph. (2019). Definice amfipatických molekul. Studie. Obnoveno z: study.com
- Lehninger, A. L. (1975). Biochemie. (2. vydání). Worth Publishers, Inc..
- Mathews, C. K., van Holde, K. E. a Ahern, K. G. (2002). Biochemie. (3. vydání). Pearson Addison Weshley.
- Helmenstine, Anne Marie, Ph.D. (31. března 2019). Co je povrchově aktivní látka? Obnoveno z: thoughtco.com
- Domenico Lombardo, Michail A. Kiselev, Salvatore Magazù a Pietro Calandra (2015). Amphiphiles Self-Assembly: Základní koncepty a budoucí perspektivy supramolekulárních přístupů. Advances in Condensed Matter Physics, sv. 2015, ID článku 151683, 22 stran, 2015. doi.org/10.1155/2015/151683.
- Anankanbil S., Pérez B., Fernandes I., Magdalena K. Widzisz, Wang Z., Mateus N. & Guo Z. (2018). Nová skupina syntetických amfifilních molekul obsahujících fenol pro víceúčelové aplikace: Fyzikálně-chemická charakterizace a studie buněčné toxicity. Scientific Reportsvolume 8, číslo článku: 832.



Zatím žádné komentáře