
Struktura, funkce a inhibitory acetylcholinesterázy
The acetylcholinesteráza (acetylcholin acetylhydroláza, EC 3.1.1.7) je enzym nacházející se hlavně v centrálním nervovém systému. Jeho úkolem, jak název napovídá, je hydrolytické zpracování neurotransmiteru acetylcholinu..
Jedná se o enzym asociovaný s buněčnou membránou, který společně s acetylcholinovým receptorem zprostředkovává excitaci postsynaptických buněk a jehož katalytický mechanismus je překvapivě rychlý.
Z mechanického hlediska lze tento enzym považovat za serinhydrolázu a v katalytické doméně svého aktivního místa obsahuje triádu aminokyselin charakteristických pro serinproteázy: serin, histidin a kyselý zbytek. Kyselý zbytek je však glutamát, zatímco serinové proteázy obvykle obsahují aspartát..
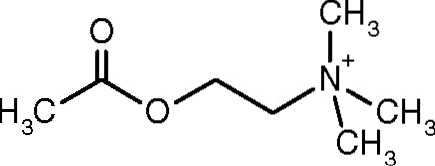
Jedno z prvních pozorování, které spojovalo katalytickou aktivitu acetylcholinesterázy s cholinergními nervovými tkáněmi a svalovými tkáněmi, provedl Dale v roce 1914; později bylo zjištěno, že je přítomen také v necholinergních neuronech a v hematopoetických, osteogenních a neoplastických buňkách.
Díky studiu různých organismů je v současné době známo, že enzym je přítomen v membráně různých typů buněk, jako jsou erytrocyty, nervové a svalové buňky, elektrické orgány a další..
Rejstřík článků
- 1 Struktura
- 1.1 Terciární a kvartérní struktura
- 1.2 Primární struktura
- 2 funkce
- 3 inhibitory
- 3.1 Ireverzibilní inhibitory
- 3.2 Reverzibilní inhibitory
- 3.3 Butyrylcholinesteráza
- 4 Acetylcholinesteráza a Alzheimerova choroba
- 5 Reference
Struktura
Terciární a kvartérní struktura
V přírodních podmínkách nebo "in vivo ", acetylcholinesteráza je polymorfní enzym, který se skládá z několika katalytických podjednotek s více či méně 80 kDa, které se skládají za vzniku oligomerní struktury (z několika podjednotek).
Množství a složitost těchto podjednotek závisí na typu buňky a uvažovaném druhu..
Některé z komplexnějších forem enzymů mají katalytické podjednotky s globulárními (G) nebo asymetrickými (A) formami spojenými disulfidovými můstky. Disulfidové můstky jsou kovalentní vazby vytvořené mezi dvěma molekulami síry thiolových skupin (-SH) dvou zbytků aminokyseliny cysteinu.
Každá podjednotka G obsahuje jedno aktivní místo, zatímco podjednotky A se obecně vyznačují tím, že mají tři strukturní domény, a to: katalytické podjednotky, kolagenové ocasy bohaté na zbytky glycinu, hydroxyprolinu a hydroxylysinu a další. Nekolagenní lepidla (jiná než kolagen).
Asymetrické formy acetylcholinesterázy jsou známé jako A12, A8 a A4, které mají 12, 8 a 4 katalytické podjednotky..
Obecně se zbytky katalytické domény v aktivním místě nacházejí v „hluboké“ oblasti podjednotek, což lze považovat za protichůdné, pokud jde o rychlou reakci, která katalyzuje tento enzym, a zjevnou nepřístupnost substrátu. na tyto stránky..
Bez ohledu na polymorfismus enzymu mají jak globulární, tak asymetrické podjednotky podobné katalytické aktivity..
Varianty
Některé buňky jiné než nervové, jako jsou erytrocyty, produkují převážně globulární dimerní acetylcholinesterázové enzymy, většinou spojené s vnějším povrchem plazmatické membrány..
Erytrocytový enzym, i když má menší strukturální složitost, je také amfipatický enzym, jehož aktivní katalytická doména se nachází ve velké hydrofilní oblasti, zatímco hydrofobní doména, která obsahuje koncovou oblast karboxylové skupiny, je odpovědná za její udržení v membráně.
Primární struktura
Hodně ze současných znalostí o sekvenci acetylcholinesterázy vyplynulo ze studia enzymu Californica torpédo, rejnok obecný, který žije v Tichém oceánu a byl tradičně používán jako modelový organismus pro studium různých proteinů nervového systému.
Acetylcholinesterázové podjednotky jsou syntetizovány jako pro-proteiny, které jsou poté zpracovány za vzniku zralých podjednotek. Každá podjednotka sestává z polypeptidu s asi 575 aminokyselinami a molekulovou hmotností 65 kDa, která je zvýšena přidáním 7-8% sacharidových zbytků (glykosylace)..
Katalytická aktivita aktivního místa podjednotek je určena serinovým zbytkem v poloze 200, který se nachází v "hluboké" oblasti katalytických podjednotek..
Různé varianty nebo izoformy enzymu existují v organismech díky různým místům pro „alternativní sestřih “ pre-poselských RNA na obou koncích (5 'a 3'). Karboxyl-terminální sekvence izoformy každé podjednotky je to, co určuje sestavení oligomerů navzájem..
Funkce
Acetylcholinesteráza je enzym s mnoha biologickými funkcemi, které nemusí nutně souviset. Fakt doložený jeho diferenciální expresí během embryogeneze, embryonální nervové extenze, svalového vývoje a synaptogeneze.
Jak bylo zdůrazněno výše, hraje důležitou roli při rychlé hydrolýze acetylcholinu, a tedy při regulaci jeho účinku v neuromuskulárním synaptickém prostoru nebo v cholinergních synaptických prostorech centrálního nervového systému..
Příkladem jeho funkcí je kontrakce kosterního svalu, ke které dochází díky typu chemické synapse známé jako motorická deska, která se nachází mezi motorickým neuronem a svalovým vláknem..
Na této synapse se dosáhne stovek vezikul nabitých acetylcholinem, které se uvolňují z motorického neuronu za účelem šíření elektrického impulsu..
Tento proces neurotransmise je poměrně složitý, avšak účast acetylcholinesterázy je zásadní pro ukončení synaptického přenosu, který závisí na neurotransmiteru acetylcholinu, protože musí být degradován a poté musí difundovat mimo synaptickou štěrbinu, aby kulminoval excitací membrány.
Enzym acetylcholinesteráza je tedy odpovědný za regulaci koncentrace tohoto vysílače v neuromotorické synapse..
Další „neklasické“ funkce enzymu souvisí s neuritogenezí nebo růstem nervových buněk; s procesy buněčné adheze, synaptogeneze, aktivace neuronů-dopaminu v substantia nigra středního mozku, hematopoetických procesů a poietického trombu, mimo jiné.
Inhibitory
Inhibitory acetylcholinesterázy působí tak, že zabraňují hydrolýze acetylcholinu, čímž zvyšují hladinu a trvání účinku tohoto neurotransmiteru. Podle mechanismu účinku je lze klasifikovat jako reverzibilní a nevratné.
Ireverzibilní inhibitory
Jsou to ty, které nevratně inhibují hydrolytickou aktivitu acetylcholinesterázy její kovalentní vazbou na serinový zbytek v aktivním místě enzymu. Tuto skupinu tvoří hlavně organofosfáty.
Obecně se jedná o aktivní sloučeniny přítomné v mnoha insekticidech a jsou odpovědné za velký počet náhodných úmrtí při otravě. Jsou to estery nebo thioly odvozené od kyseliny fosforečné, fosfonové, fosfinové nebo fosforamidové.
Sarin, tabun, soman a cyklosarin patří mezi nejtoxičtější sloučeniny syntetizované člověkem, protože mohou zabít člověka vyvoláním respiračního a oběhového selhání blokováním acetylcholinesterázy v periferním nervovém systému..
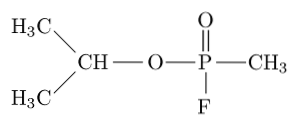
Například Sarin je „nervový plyn“, který se používá jako chemická zbraň pro teroristické účely..
Reverzibilní inhibitory
Toto pořadí klasifikačních skupin konkurenčních a nekompetitivních inhibitorů, které fungují přechodnou a reverzibilní karbamylací serinového zbytku v aktivním místě, a mnoho z nich bylo syntetizováno a purifikováno z rostlinných nebo houbových zdrojů..
Karbamáty, jako je fyzostigmin a neostigmin, jsou reverzibilní inhibitory, které se používají jako léky k léčbě nemocí, jako je glaukom a myasthenia gravis..
Další terapeutická činidla v této skupině se také používají k léčbě Alzheimerovy choroby, Parkinsonovy choroby, pooperačních střevních obstrukcí (pooperační ileus), distenze močového měchýře a jako antidota při předávkování anticholinergiky..
Butyrylcholinesteráza
Zajímavý přirozený mechanismus proti některým látkám inhibujícím acetylcholinesterázu má co do činění s účastí méně specifického enzymu známého jako butyrylcholinesteráza.
Tento enzym je také schopen hydrolyzovat acetylcholin a současně může působit jako molekulární návnada, která reaguje s těmito toxiny dříve, než projeví negativní účinek na acetylcholinesterázu..
Acetylcholinesteráza a Alzheimerova choroba
Ukázalo se, že acetylcholinesteráza tvoří stabilní komplex se složkami senilních plaků charakteristických pro patologii. Kromě toho některé změněné glykosylační vzorce tohoto enzymu souvisejí s přítomností a tvorbou amyloidových plaků v mozku..
Mnoho z reverzibilních inhibitorů acetylcholinesterázy bylo proto použito jako léky první generace k léčbě tohoto onemocnění a dalších souvisejících neurodegenerativních stavů. Patří mezi ně donepezil, rivastigmin a galantamin..
Reference
- Dvir, H., Silman, I., Harel, M., Rosenberry, T. L., & Sussman, J. L. (2010). Acetylcholinesteráza: Od 3D struktury k funkci. Chemicko-biologické interakce, 187, 10-22.
- Houghton, P., Ren, Y., & Howes, M. (2006). Inhibitory acetylcholinesterázy z rostlin a hub. Zprávy o přírodních produktech, 2. 3, 181-199.
- Krsti, D. Z., Lazarevi, T. D., Bond, A. M. a Vasi, V. M. (2013). Inhibitory acetylcholinesterázy: farmakologie a toxikologie. Současná neurofarmakologie, jedenáct, 315-335.
- Mukherjee, P. K., Kumar, V., Mal, M., & Houghton, P. J. (2007). Inhibitory acetylcholinesterázy z rostlin. Fytomedicin, 14, 289-300.
- Quinn, D. M. (1987). Acetylcholinesteráza: Struktura enzymu, dynamika reakce a stavy virtuálního přechodu. Chem. Rev., 87, 955-979.
- Racchi, M., Mazzucchelli, M., Porrello, E., Lanni, C., & Govoni, S. (2004). Inhibitory acetylcholinesterázy: nové aktivity starých molekul. Farmakologický výzkum, padesátka, 441-451.
- Rosenberry, T. (1975). Acetylcholinesteráza. Pokroky v enzymologii a souvisejících oblastech molekulární biologie, 43, 103-218.
- Soreq, H., & Seidman, S. (2001). Acetylcholinesteráza - nové role pro starého herce. Recenze přírody, dva, 294-302.
- Talesa, V. N. (2001). Acetylcholinesteráza u Alzheimerovy choroby. Mechanismy stárnutí a rozvoje, 122, 1961-1969.


Zatím žádné komentáře