
Struktura, použití, vlastnosti citrátu sodného (C6H5O7Na3)
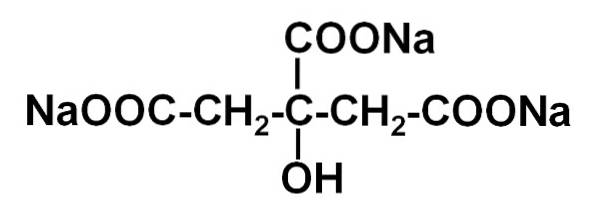
The citrát sodný Je to sodná sůl kyseliny citronové. Je tvořen citrátovým aniontem C6H5NEBO73- a tři sodné kationty Na+. Jeho molekulární vzorec je C6H5NEBO7Na3 nebo v rozšířené formě: NaOOC-CHdva-C (COONa) (OH) -CHdva-COONa. Citrát sodný je konjugovaná báze kyseliny citronové, to znamená, že se z ní teoreticky získává nahrazením každého H protonu+ -COOH pro sodík Na+.
Může být připraven v bezvodé formě (bez složení vody) nebo v hydratované formě se 2 nebo 5 molekulami vody. Je to sloučenina, která má bezvodý (bez vody) sklon absorbovat vodu z okolního prostředí.
Citrát sodný působí jako pufr, což znamená, že stabilizuje pH, což je míra kyselosti nebo zásaditosti vodného roztoku. Má také vlastnost vytvářet stabilní sloučeninu s ionty vápníku Ca.dva+, citrát vápenatý.
Používá se například v potravinářském průmyslu, aby se zabránilo tvorbě kravského mléka hrudky, které jsou pro kojence obtížně stravitelné.
V biologických testovacích laboratořích se používá k zabránění srážení krve odebrané pacientům pro určité testy. Zabraňuje také srážení krve použité při transfuzích. Je široce používán v detergentech bez fosfátů, protože neznečišťuje.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Rozpustnost
- 3,5 pH
- 3.6 Chemické vlastnosti
- 3.7 Další vlastnosti
- 4 Získání
- 4.1 Poloha v přírodě
- 5 použití
- 5.1 V potravinářském průmyslu
- 5.2 V medicíně
- 5.3 Ve farmaceutickém průmyslu
- 5.4 V krevních testech
- 5.5 Při syntéze nanočástic
- 5.6 V pracích prostředcích šetrných k životnímu prostředí
- 5.7 Zlepšení využívání dehtových písků
- 5.8 V jiných aplikacích
- 6 Reference
Struktura
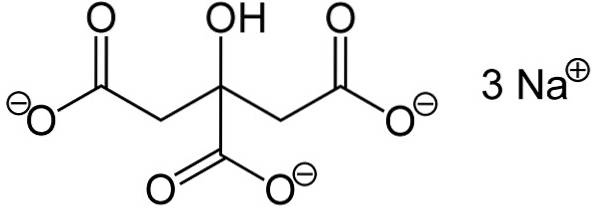
Citrát trisodný se skládá ze tří iontů sodíku sodného+ a citrátový ion.
Citrátový iont je tvořen řetězcem tří atomů uhlíku, ke kterému jsou připojeny 3 karboxyláty -COO- (jeden pro každý atom uhlíku) a hydroxyl -OH na centrálním uhlíku.
Každý ze 3 iontů Na+ je připojen ke skupině -COO-.
Nomenklatura
- Citrát sodný
- Citrát trisodný
- 2-hydroxypropan-l, 2,3-trikarboxylát trisodný
Vlastnosti
Fyzický stav
Bílá nebo bezbarvá krystalická pevná látka.
Molekulární váha
258,07 g / mol
Bod tání
300 ° C
Rozpustnost
Je velmi rozpustný ve vodě: 42,5 g / 100 ml při 25 ° C. Je prakticky nerozpustný v alkoholu.
pH
5% vodný roztok citrátu sodného má pH mezi 7,5 a 9,0, to znamená, že je mírně zásaditý.
Chemické vlastnosti
Citrát sodný je pufr, což znamená, že stabilizuje pH, což je měřítkem kyselosti nebo zásaditosti vodného roztoku. Citrát stabilizací pH neumožňuje okyselení nebo alkalizaci roztoku nad určité hodnoty.
Když jsou přebytečné protony H+ vezme je k převodu jejich -COO skupin- ve skupinách -COOH. Naopak, pokud existuje mnoho skupin OH- vzdá se protonů svých -COOH skupin a převádí je na -COO-.
Když je transformován tělem, poskytuje 3 molekuly HCO3- pro každou citrátovou molekulu.
Další vlastnosti
Jeho krystaly jsou křehké, to znamená, že absorbují vodu ze vzduchu. Citrát sodný dihydrát je stabilnější na vzduchu.
Pokud se dihydrát zahřeje, po dosažení 150 ° C se stane bezvodým (bez vody).
Stejně jako kyselina citronová, citrát sodný chutná kysele.
Získávání
Citrát sodný se obvykle vyrábí přidáním uhličitanu sodného do roztoku kyseliny citronové, dokud neustane šumění. Šumění je způsobeno vývojem oxidu uhličitého COdva:
NadvaCO3 + Kyselina citronová → citrát sodný + COdva↑
Poté se voda z roztoku odpaří, aby produkt krystalizoval.
Může být také připraven zpracováním roztoku síranu sodného citrátem vápenatým:
NadvaSW4 + Citrát vápenatý → Citrát sodný + CaSO4↓
Roztok se filtruje, aby se odstranil CaSO4 pevná látka, která se vysráží. Poté se roztok koncentruje a tak citrát sodný krystalizuje.
Poloha v přírodě
Citrát sodný je konjugovaná báze kyseliny citronové, což je přírodní sloučenina vyskytující se ve všech živých organismech, protože je součástí jejich metabolismu, což je mechanismus pro vývoj energie v buňkách..
Aplikace
V potravinářském průmyslu
Citrát sodný má v potravinářském průmyslu různá použití, například jako regulátor kyselosti, sekvestrant, stabilizátor, povrchově aktivní látka nebo emulgátor..
Používá se mimo jiné do nápojů, mražených dezertů a speciálních sýrů.
Umožňuje zabránit srážení mléka, proto se přidává do kravského mléka, které se používá k výživě kojících dětí. Tímto způsobem nedochází k tvorbě sraženin nebo tvrdých tvarohů, které jsou těžko stravitelné, v žaludku dětí..

Používá se k urychlení fixace barvy u uzeného vepřového nebo hovězího masa, tj. Masa, které bylo ošetřeno, aby se zabránilo znehodnocení. V nich je nahrazeno až 50% kyseliny askorbové.

Používá se také k prevenci srážení krve u čerstvého hovězího masa (například steaků).
V medicíně
Používá se jako alkalizační látka, protože neutralizuje přebytečnou kyselinu v krvi a moči. Je indikován k léčbě metabolické acidózy, ke které dochází, když tělo produkuje příliš mnoho kyseliny.
Po požití se z citrátového iontu stane hydrogenuhličitanový iont, který je systémovým alkalizačním činidlem (tj. Celého organismu) a v důsledku toho jsou ionty H neutralizovány.+, zvyšuje pH krve a zvrací nebo eliminuje acidózu.
Citrát sodný slouží jako neutralizační činidlo pro podrážděný žaludek.
Používá se jako expektorans a sudorific. Má močopudný účinek. Zvyšuje vylučování vápníku močí, a proto se používá při hyperkalcémii, kdy dochází k nadbytku vápníku v krvi.
Slouží také k usnadnění odstranění olova, když dojde k otravě olovem..
Pokud je podáván v nadměrném množství, může mimo jiné způsobit alkalózu, svalové křeče v důsledku nesprávné funkce příštítných tělísek a depresi srdečních funkcí v důsledku snížení hladiny vápníku v krvi..
Citrát sodný se používá při transfuzích. Přidává se do krve spolu s dextrózou, aby se zabránilo srážení.
Normálně játra rychle metabolizují citrát získaný při transfuzi, avšak během transfuzí velkého množství může být kapacita jater překročena..
V takových případech, protože citrát tvoří komplex s vápníkem, dochází ke snížení iontu vápníku Ca.dva+ v krvi. To může vést k závratě, třesu, brnění atd. Transfuze proto musí být prováděny pomalu.
Ve farmaceutickém průmyslu
Kromě mnoha dalších použití se používá k prevenci ztmavnutí léčiv, ve kterých jsou železo a třísloviny.
V krevních testech
Používá se jako antikoagulant při odběru krve nebo při jeho skladování, protože působí jako chelátor iontů vápníku Cadva+, to znamená, že se váže na ionty vápníku a tvoří citrát vápenatý, který není ionizovaný.
Používá se při koagulačních testech a při stanovení rychlosti sedimentace červených krvinek..
Používá se jako antikoagulant během plazmaferézy, postupu k odstranění přebytečných látek, které jsou pro tělo škodlivé z krve..
Při syntéze nanočástic
Používá se jako stabilizátor při syntéze nanočástic zlata. K kyselině chloroaurové se přidá dihydrát citronanu trisodného za vzniku vínově červené suspenze..
Citrát sodný slouží jako redukční činidlo a jako protidestičkový prostředek, protože se adsorbuje na nanočástice..
Kvůli negativnímu náboji citrátu se částice navzájem odpuzují, aby se zabránilo aglomeraci a vytvořily stabilní disperzi. Čím vyšší je koncentrace citrátu, tím menší jsou částice..
Tyto nanočástice se používají k přípravě lékařských biosenzorů.
V pracích prostředcích šetrných k životnímu prostředí
Citrát sodný je široce používán v kapalných detergentech bez fosfátů. Je to proto, že jeho chování v životním prostředí je neškodné, protože je to metabolit nacházející se ve všech živých organismech..
Je snadno biologicky odbouratelný a slabě toxický pro vodní organismy. Z tohoto důvodu je považován za čisticí prostředek s ekologicky příznivými vlastnostmi..
Při zlepšování využívání dehtových písků
Ropné písky jsou písčité útvary bohaté na bitumen nebo dehet, materiál podobný ropě.
Citrát sodný byl úspěšně testován ve spojení s hydroxidem sodným NaOH k extrakci oleje z dehtových písků.
Předpokládá se, že spojením citrátu s pískovcem, ionty -COO- Citrát tvoří velké množství negativních nábojů na částicích oxidu křemičitého. Tím se dosáhne lepšího oddělení písku od bitumenu jednoduchým odpuzováním negativních nábojů štěrku od negativních nábojů bitumenu.
V jiných aplikacích
Používá se ve fotografii, k odstraňování stopových kovů, při galvanickém pokovování a k odstraňování SOdva odpadní plyny.
Reference
- NÁS. Národní lékařská knihovna. (2019). Citrát sodný. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- McNamara, C. (2017). Odběr a manipulace s krví. In Dacie and Lewis Practical Hematology (Dvanácté vydání). Obnoveno ze sciencedirect.com.
- Steber, J. (2007). Ekotoxicita složek čisticích prostředků. V příručce pro čištění / dekontaminaci povrchů. Obnoveno ze sciencedirect.com.
- Xiang, B. a kol. (2019). Studie úlohy citrátu sodného při osvobozování bitumenu. Energetická paliva 2019, 33, 8271-8278. Obnoveno z pubs.acs.org.
- Heddle, N. a Webert, K.E. (2007). Transfuzní medicína. In Blood Banking and Transfusion Medicine (druhé vydání). Obnoveno ze sciencedirect.com.
- Sudhakar, S. a Santhosh, P.B. (2017). Zlaté nanomateriály. In Advances in Biomembranes and Lipid Self-Assembly. Obnoveno ze sciencedirect.com.
- Elsevier (redakční) (2018). Kapitola 8. Nanometal. In Fundamentals and Applications of Nano Silicon in Plasmonics and Fullerines. Současné a budoucí trendy Micro a Nano Technologies. Stránky 169-203. Obnoveno ze sciencedirect.com.



Zatím žádné komentáře