
Struktura chloridu železnatého (FeCl2), použití, vlastnosti

The chlorid železnatý je anorganická pevná látka vytvořená spojením kationtu Fedva+ a dva chloridové anionty Cl-. Jeho chemický vzorec je FeCldva. Má tendenci absorbovat vodu z prostředí. Jedním z jeho hydrátů je tetrahydrát FeCldva•4HdvaNebo což je nazelenalá pevná látka.
Je třeba poznamenat, že je velmi rozpustný ve vodě a má tendenci snadno oxidovat za přítomnosti vzduchu za vzniku chloridu železitého FeCl.3. Protože je snadno oxidovatelný, a proto je schopen působit jako redukční činidlo, je široce používán v chemických a biologických výzkumných laboratořích..

Chlorid železitý má několik použití, z nichž nejdůležitější je pomoc jiným činitelům při oxidaci kalů pocházejících z odpadních vod nebo čištění odpadních vod. Používá se také při procesu potahování kovů kovy a má určité využití ve farmaceutickém průmyslu..
Bylo také experimentováno s použitím FeCldva při získávání cenných kovů z použitých katalyzátorů nalezených ve výfukovém potrubí vozidel poháněných benzínem nebo naftou.
Používá se v textilním průmyslu k fixaci barev u některých druhů látek.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Specifická hmotnost
- 3.6 Rozpustnost
- 3.7 Další vlastnosti
- 4 Získání
- 5 použití
- 5.1 Při barvení látek
- 5.2 Při čištění odpadních vod
- 5.3 V chemických studiích
- 5.4 V biochemických studiích
- 6 Reference
Struktura
Chlorid železnatý je tvořen železnatým iontem Fedva+ a dva chloridové ionty Cl- spojené iontovými vazbami.
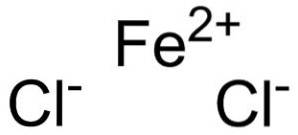
Železný ion Fedva+ má následující elektronickou strukturu:
1 sdva, 2 sdva 2 str6, 3 sdva 3p6 3d6, 4 s0
kde je vidět, že ztratil dva elektrony ze skořápky 4s.
Tato konfigurace není příliš stabilní a z tohoto důvodu má tendenci oxidovat, tj. Ztrácet další elektron, tentokrát z 3D vrstvy, za vzniku iontu Fe.3+.
Chloridový iont Cl- má následující elektronickou strukturu:
1 sdva, 2 sdva 2 str6, 3 sdva 3p6
kde vidíte, že získal další elektron ve skořápce 3p a dokončil jej. Tato konfigurace je velmi stabilní, protože všechny elektronické vrstvy jsou kompletní.
Nomenklatura
- Chlorid železnatý
- Chlorid železitý
- Dichlorid železa
- Tetrahydrát chloridu železnatého: FeCldva•4HdvaNEBO
Vlastnosti
Fyzický stav
Bezbarvá až světle zelená pevná látka, krystaly.
Molekulární váha
126,75 g / mol
Bod tání
674 ° C
Bod varu
1023 ° C
Specifická hmotnost
3,16 při 25 ° C / 4 ° C
Rozpustnost
Velmi dobře rozpustný ve vodě: 62,5 g / 100 ml při 20 ° C. Rozpustný v alkoholu, acetonu. Mírně rozpustný v benzenu. Prakticky nerozpustný v etheru.
Další vlastnosti
FeCldva bezvodý je velmi hygroskopický. Snadno absorbuje vodu z prostředí a vytváří různé hydráty, zejména tetrahydrát, ve kterém pro každou molekulu FeCldva existují 4 molekuly HdvaNebo k tomu připojené (FeCldva•4HdvaNEBO).
Za přítomnosti vzduchu pomalu oxiduje na FeCl3. To znamená, že ion Fedva+ snadno se oxiduje na iont Fe3+.
Při zahřátí za přítomnosti vzduchu rychle vzniká chlorid železitý FeCl3 a oxid železitý FedvaNEBO3.
FeCldva je korozivní pro kovy a tkaniny.
Získávání
Získává se zpracováním přebytku železného kovu Fe vodným roztokem kyseliny chlorovodíkové HCl při vysokých teplotách..
Víra0 + 2 HCl → FeCldva + 2 h+
Avšak v důsledku přítomnosti vody tímto způsobem se získá chlorid železitý tetrahydrát FeCl.dva•4HdvaNEBO.
Pro získání bezvodého (bez vody zabudované v krystalech) se někteří vědci rozhodli provést reakci železného prášku s bezvodým HCl (bez vody) v rozpouštědle tetrahydrofuranu (THF) při teplotě 5 ° C..
Tímto způsobem se získá sloučenina FeCldva•1,5THF, který při zahřátí na 80-85 ° C ve vakuu nebo v atmosféře dusíku (aby se zabránilo přítomnosti vody) produkuje FeCldva bezvodý.
Aplikace
Chlorid železitý má různá použití, obvykle na základě své redukční kapacity, to znamená, že může být snadno oxidován. Používá se například v barvách a nátěrech, protože je pomáhá fixovat na povrch.
Železo je základní mikroživina pro zdraví lidí a zvířat. Podílí se na syntéze bílkovin, dýchání a množení buněk.
Proto FeCldva používá se ve farmaceutických přípravcích. Fe iontdva+ jako takový je lépe absorbován než iont Fe3+ ve střevech.
Používá se k výrobě FeCl3. Používá se v metalurgii, v lázních na potahování železa, k zajištění tvárnějšího povlaku.
Zde jsou další doporučená použití.
V barvení tkanin
FeCldva Používá se jako mořidlo nebo fixátor barviva u některých druhů tkanin. Mořidlo reaguje chemicky a váže se současně na barvivo a textilii a vytváří na něm nerozpustnou sloučeninu..
Tímto způsobem zůstane barvivo fixováno k látce a jeho barva zesílí..
Při čištění odpadních vod
FeCldva používá se v čistírnách odpadních vod nebo čistírnách odpadních vod (kanalizace).
V této aplikaci se chlorid železnatý podílí na oxidaci kalu procesem zvaným Fentonova oxidace. Tato oxidace způsobuje rozpad vloček bláta a umožňuje uvolňování vody, která je na něj silně vázána..

Kal lze poté vysušit a ekologicky zlikvidovat. Použití chloridu železnatého pomáhá snížit náklady na tento proces.
Nedávno bylo také navrženo jeho použití ke snížení tvorby sirovodíku nebo sirovodíku v těchto odpadních vodách..
Tímto způsobem by se snížila koroze způsobená tímto plynem a také nepříjemný zápach..
V chemických studiích
Díky svým redukčním vlastnostem (opak oxidantu), FeCldva Je široce používán v různých výzkumech v chemii, fyzice a technických laboratořích.
Někteří vědci používali páry chloridu železitého k extrakci cenných kovů, jako je platina, palladium a rhodium, z použitých katalyzátorů ve vozidlech na benzín nebo naftu..
Tyto katalyzátory se používají k odstraňování plynů, které jsou škodlivé pro člověka a životní prostředí. Jsou umístěny ve výfukovém potrubí osobních a nákladních automobilů na benzín nebo naftu.

Po určité době se katalyzátor vozidla opotřebuje a ztratí svoji účinnost a musí být vyměněn. Upotřebený katalyzátor je vyřazen a probíhají snahy o získání cenných kovů, které obsahuje..

Podle vědců tyto kovy tvořily magnetické slitiny se železem v chloridu železnatém..
Slitiny bylo možné extrahovat pomocí magnetů a poté cenné kovy získat známými metodami..
V biochemických studiích
Za držení kationtu Fedva+, což je důležitá mikroživina u lidí a některých zvířat, FeCldva používá se ve studiích biochemie a medicíny.
Některé studie ukázaly, že chlorid železitý zlepšuje fungicidní účinnost studené argonové plazmy..
Studená plazma je technologie používaná ke sterilizaci lékařských povrchů a nástrojů. Je založen na tvorbě hydroxylových radikálů OH · z vlhkosti prostředí. Tyto radikály reagují s buněčnou stěnou mikroorganismu a způsobují jeho smrt.
V tomto šetření FeCldva zlepšil účinek studené plazmy a urychlil eliminaci houby rezistentní vůči jiným dezinfekčním metodám.
Někteří vědci zjistili, že použití FeCldva umožňuje zvýšit výtěžek reakcí k získání glukózy počínaje bagasou z cukrové třtiny.
V tomto případě je Fedva+ je nezbytným mikroelementem pro lidské zdraví, jeho přítomnost ve stopách ve výrobku by na člověka neměla vliv.
Reference
- Fukuda, S. a kol. (2019). Chlorid železnatý a síran železnatý zlepšují fungicidní účinnost studené atmosférické argonové plazmy na melanizované Aureobasidium pullulans. J Biosci Bioeng, 2019, 128 (1): 28-32. Obnoveno z ncbi.clm.nih.gov.
- Ismal, O.E. a Yildirim, L. (2019). Kovová mořidla a biologická mořidla. In The Impact and Perspects of Green Chemistry for Textile Technology. Kapitola 3, str. 57-82. Obnoveno ze sciencedirect.com.
- Zhang, W. a kol. (2019). Kokatalýza chloridu hořečnatého a chloridu železnatého na produkci xylo-oligosacharidů a glukózy z bagasy z cukrové třtiny. Bioresour Technol 2019, 291: 121839. Obnoveno z ncbi.nlm.nih.gov.
- Zhou, X. a kol. (2015). Role původního železa při zlepšování odvodnění kalů pomocí peroxidace. Vědecké zprávy 5: 7516. Obnoveno z ncbi.nlm.nih.gov.
- Rathnayake, D. a kol. (2019). Regulace sirovodíku v kanalizaci katalyzováním reakce s kyslíkem. Science of the Total Environment 689 (2019) 1192-1200. Obnoveno z ncbi.nlm.nih.gov.
- Taninouchi, Y. a Okabe, T.H. (2018). Obnova kovů skupiny platiny z použitých katalyzátorů pomocí zpracování parami chloridem železitým. Metall a Materi Trans B (2018) 49: 1781. Obnoveno z odkazu.springer.com.
- NÁS. Národní lékařská knihovna. (2019). Chlorid železnatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Aresta, M. a kol. (1977). Oxidace železa (0) chlorovodíkem v tetrahydrofuranu: jednoduchá cesta k bezvodému chloridu železnatému. Anorganic Chemistry, sv. 16, č. 7, 1977. Obnoveno z pubs.acs.org.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.



Zatím žádné komentáře