
Varianta elektronické afinity v periodické tabulce a příklady
The Elektronická afinita nebo elektro-afinita je míra energetické variace atomu v plynné fázi, když obsahuje elektron do své valenční skořápky. Jakmile je elektron získán atomem A, výsledný anion A- může nebo nemusí být stabilnější než váš výchozí stav. Proto může být tato reakce endotermická nebo exotermická..
Podle konvence, když je elektronový zisk endotermický, je hodnotě elektronové afinity přiřazeno kladné znaménko „+“; Na druhou stranu, pokud je exotermická - tedy, uvolňuje energii - tato hodnota má záporné znaménko „-“. V jakých jednotkách jsou tyto hodnoty vyjádřeny? V kJ / mol nebo v eV / atom.
Pokud by byl prvek v kapalné nebo pevné fázi, jeho atomy by vzájemně interagovaly. To by způsobilo, že se energie absorbovaná nebo uvolněná v důsledku elektronického zisku rozptýlí mezi všechny tyto, což přinese nespolehlivé výsledky..
Na druhé straně se v plynné fázi předpokládá, že jsou izolovány; jinými slovy, s ničím nekomunikují. Atomy zapojené do této reakce jsou: A (g) a A-(G). Zde (g) označuje, že atom je v plynné fázi.
Rejstřík článků
- 1 První a druhá elektronická příbuznost
- 1.1 Nejprve
- 1,2 sekundy
- 2 Jak se elektronová afinita mění v periodické tabulce
- 2.1 Variace jádra a efekt stínění
- 2.2 Variace podle elektronové konfigurace
- 3 příklady
- 3.1 Příklad 1
- 3.2 Příklad 2
- 4 Odkazy
První a druhá elektronická příbuznost
První
Reakce elektronického zisku může být reprezentována jako:
A (g) + e- => A-(g) + E nebo jako A (g) + e- + E => A-(G)
V první rovnici se E (energie) nachází jako produkt na levé straně šipky; a ve druhé rovnici se energie počítá jako reaktivní a nachází se na pravé straně. To znamená, že první odpovídá exotermickému elektronickému zisku a druhý endotermickému elektronickému zisku.
V obou případech je však do valenčního pláště atomu A přidán pouze jeden elektron..
Druhý
Je také možné, že jakmile se vytvoří záporný iont A-, znovu absorbuje další elektron:
NA-(g) + e- => Adva-(G)
Hodnoty druhé elektronové afinity jsou však kladné, protože je třeba překonat elektrostatické odpuzování mezi záporným iontem A- a příchozí elektron e-.
Co určuje, že plynný atom lépe „přijímá“ elektron? Odpověď se v zásadě nachází v jádru, ve stínícím účinku vnitřních elektronických vrstev a ve valenční vrstvě.
Jak se elektronová afinita mění v periodické tabulce
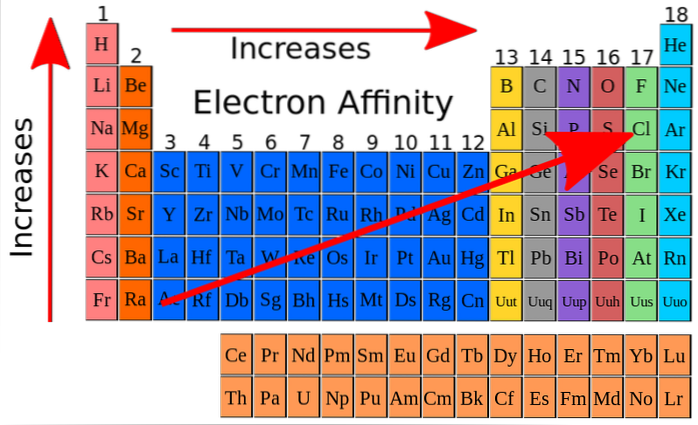
Na horním obrázku červené šipky označují směry, ve kterých se zvyšuje elektronická afinita prvků. Z toho lze elektronovou afinitu chápat jako jednu z dalších periodických vlastností, se zvláštností, že představuje mnoho výjimek.
Elektronová afinita se zvyšuje vzestupně skupinami a také se zvyšuje zleva doprava podél periodické tabulky, zejména v blízkosti atomu fluoru. Tato vlastnost úzce souvisí s atomovým poloměrem a energetickými hladinami jeho orbitalů..
Variace podle jádra a stínění
Jádro má protony, což jsou kladně nabité částice, které vyvíjejí přitažlivou sílu na elektrony v atomu. Čím blíže jsou elektrony jádru, tím větší přitažlivost pociťují. Jak se tedy zvyšuje vzdálenost od jádra k elektronům, tím menší jsou přitažlivé síly..
Kromě toho elektrony vnitřního obalu pomáhají „chránit“ účinek jádra na elektrony nejvzdálenějších obalů: valenční elektrony..
To je způsobeno samotnými elektronickými odpuzováními mezi jejich zápornými náboji. Proti tomuto jevu však působí zvýšení atomového čísla Z.
Jak výše uvedené souvisí s elektronickou afinitou? Že plynný atom A bude mít větší tendenci získávat elektrony a tvořit stabilní záporné ionty, když je stínící účinek větší než odpudění mezi přicházejícím elektronem a odpory valenčního pláště.
Opak nastává, když jsou elektrony velmi daleko od jádra a odpuzování mezi nimi nezhoršuje elektronický zisk..
Například sestup do skupiny „otevírá“ nové energetické úrovně, které zvětšují vzdálenost mezi jádrem a vnějšími elektrony. Z tohoto důvodu se při vzestupu skupinami zvyšuje elektronická spřízněnost.
Variace podle elektronové konfigurace
Všechny orbitaly mají své energetické úrovně, takže pokud nový elektron obsadí orbitál s vyšší energií, atom bude muset energii absorbovat, aby to bylo možné..
Kromě toho způsob, jakým elektrony zaujímají orbitaly, může nebo nemusí upřednostňovat elektronický zisk, čímž rozlišuje rozdíly mezi atomy..
Například pokud jsou všechny elektrony nepárové na orbitálech p, zahrnutí nového elektronu způsobí vytvoření párového páru, který působí odpudivé síly na ostatní elektrony..
To je případ atomu dusíku, jehož elektronová afinita (8 kJ / mol) je nižší než pro atom uhlíku (-122 kJ / mol).
Příklady
Příklad 1
První a druhá elektronická afinita ke kyslíku je:
O (g) + e- => O.-(g) + (141 kJ / mol)
NEBO-(g) + e- + (780 kJ / mol) => O.dva-(G)
Konfigurace elektronů pro O je 1 sdva2 sdva2 str4. Existuje již spárovaný pár elektronů, které nemohou překonat přitažlivou sílu jádra; elektronický zisk proto uvolňuje energii po vytvoření stabilního iontu O.-.
Nicméně, ačkoli Odva- Má stejnou konfiguraci jako neon vzácného plynu, jeho elektronické odpuzování překračuje přitažlivou sílu jádra a pro umožnění vstupu elektronu je nutný energetický příspěvek.
Příklad 2
Pokud se porovná elektronická příbuznost prvků skupiny 17, získá se následující:
F (g) + e- = F-(g) + (328 kJ / mol)
Cl (g) + e- = Cl-(g) + (349 kJ / mol)
Br (g) + e- = Br-(g) + (325 kJ / mol)
I (g) + e- = Já-(g) + (295 kJ / mol)
Od shora dolů - sestupně ve skupině - se zvyšují atomové poloměry, stejně jako vzdálenost mezi jádrem a vnějšími elektrony. To způsobí nárůst elektronických afinit; fluor, který by měl mít nejvyšší hodnotu, je však překonán chlorem.
Proč? Tato anomálie ukazuje účinek elektronických odpuzování na atraktivní sílu a nízké stínění..
Protože je to velmi malý atom, fluor „kondenzuje“ všechny své elektrony v malém objemu, což na rozdíl od jeho objemnějších kongenerů (Cl, Br a I) způsobuje větší odpor na přicházejícím elektronu..
Reference
- Chemistry LibreTexts. Elektronová afinita. Citováno dne 4. června 2018 z: chem.libretexts.org
- Jim Clark. (2012). Elektronová afinita. Citováno dne 4. června 2018 z: chemguide.co.uk
- Carl R. Nave. Elektronové spříznění prvků hlavní skupiny. Citováno dne 4. června 2018 z: hyperphysics.phy-astr.gsu.edu
- N. De Leon. Elektronová afinita. Citováno dne 4. června 2018 z: iun.edu
- Helmenstine, Anne Marie, Ph.D. (27. května 2016). Definice elektronové afinity. Citováno dne 4. června 2018 z: thoughtco.com
- Cdang. (3. října 2011). Elektronová afinita periodická tabulka. [Postava]. Citováno dne 4. června 2018 z: commons.wikimedia.org
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 227-229.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., Str. 29). Mc Graw Hill.



Zatím žádné komentáře