
Struktura primárního alkoholu, vlastnosti, nomenklatura, příklady
A primární alkohol je skupina, ve které je hydroxylová skupina připojena k primárnímu uhlíku; tj. uhlík kovalentně navázaný na jiný uhlík a vodíky. Jeho obecný vzorec je ROH, konkrétně RCHdvaOH, protože existuje pouze jedna alkylová skupina R.
Skupina R vzorce RCHdvaOH může být jakýkoli: řetězec, kruh nebo heteroatomy. Pokud jde o řetězec, krátký nebo dlouhý, jedná se o nejreprezentativnější primární alkoholy; mezi nimi je methanol a ethanol, dva z nejvíce syntetizovaných na průmyslové úrovni.

Fyzicky jsou jako jiné alkoholy a jejich teploty varu nebo tání závisí na stupni jejich větvení; ale chemicky jsou nejreaktivnější. Kromě toho je jeho kyselost vyšší než kyselost sekundárních a terciárních alkoholů.
Primární alkoholy procházejí oxidačními reakcemi a stávají se velkým množstvím organických sloučenin: estery a ethery, aldehydy a karboxylové kyseliny. Podobně mohou podstoupit dehydratační reakce a transformovat se na alkeny nebo olefiny.
Rejstřík článků
- 1 Struktura primárního alkoholu
- 2 Vlastnosti
- 2.1 Kyselost
- 2.2 Chemické reakce
- 3 Názvosloví
- 4 příklady
- 5 Reference
Struktura primárního alkoholu
Nejreprezentativnější jsou primární alkoholy odvozené od lineárních alkanů. Ve skutečnosti však lze do tohoto typu alkoholů zařadit jakoukoli strukturu, ať už lineární nebo rozvětvenou, pokud je skupina OH vázána na CHdva.
Takže strukturně mají všichni společnou přítomnost skupiny -CHdvaOH, nazývaný methylol. Charakteristickým rysem a důsledkem této skutečnosti je, že OH skupině je méně bráněno; to znamená, že může interagovat s prostředím bez prostorové interference jiných atomů.
Podobně méně bráněný OH znamená, že atom uhlíku, který jej nese, je atom CHdva, mohou podstoupit substituční reakce prostřednictvím mechanismu SNdva (bimolekulární, bez tvorby karbokationtu).
Na druhou stranu, OH s větší volností interakce s médiem se překládá jako silnější intermolekulární interakce (vodíkovými vazbami), což zase zvyšuje teploty tání nebo varu.
Totéž se děje s jeho rozpustností v polárních rozpouštědlech, pokud skupina R není příliš hydrofobní..
Vlastnosti
Kyselost
Primární alkoholy jsou nejvíce kyselé. Aby se alkohol choval jako kyselina Bronstedova, musíte darovat iont H+ do média, řekněme do vody, aby se stal alkoxidovým aniontem:
ROH + HdvaNEBO <=> RO- + H3NEBO+
Záporný náboj RO-, konkrétně z RCHdvaNEBO-, je méně odpuzován elektrony ve dvou C-H vazbách než elektrony ve C-R vazbě.
Alkylová skupina poté vykazuje největší odpor, destabilizuje RCHdvaNEBO-; ale ne tolik ve srovnání s tím, pokud by existovaly dvě nebo tři skupiny R, jak je tomu u sekundárních a terciárních alkoholů.
Dalším způsobem, jak vysvětlit vyšší kyselost primárního alkoholu, je rozdíl v elektronegativitě, který vytváří dipólový moment: HdvaCδ+-NEBOδ-H. Kyslík přitahuje elektronovou hustotu z obou CHdva jako z H; kladný částečný náboj uhlíku trochu odpuzuje vodík.
Skupina R přenáší část své elektronové hustoty na CHdva, což pomáhá snížit jeho kladný částečný náboj a tím i jeho odpuzování pro vodíkový náboj. Čím více R skupin existuje, tím nižší je odpudivost, a proto je tendence H uvolňovat jako H+.
pKa
Primární alkoholy jsou považovány za slabší kyseliny než voda, s výjimkou methylalkoholu, který je o něco silnější. PKa methylalkoholu je 15,2; a pKa ethylalkoholu je 16,0. Mezitím je pKa vody 15,7.
Voda, která je považována za slabou kyselinu, jako jsou alkoholy, se však může vázat na H+ transformovat na hydroniový ion, H3NEBO+; to znamená, že se chová jako základna.
Stejným způsobem mohou primární alkoholy přijímat vodík; zejména při některých vlastních reakcích, například při jeho transformaci na alkeny nebo olefiny.
Chemické reakce
Tvorba alkylhalogenidů
Alkoholy reagují s halogenovodíky za vzniku alkylhalogenidů. Reaktivita alkoholů vůči halogenovodíkům klesá v tomto pořadí:
Terciární alkohol> sekundární alkohol> primární alkohol
ROH + HX => RX + HdvaNEBO
RX je primární alkylhalogenid (CH3Cl, CH3CHdvaBr atd.).
Dalším způsobem, jak připravit alkylhalogenidy, je reakce thionylchloridu, syntetického činidla, s primárním alkoholem, který se převede na alkylchlorid. Thionylchlorid (SOCldva) vyžaduje k reakci přítomnost pyridinu.
CH3(CHdva)3CHdvaOH + SOCldva => CH3(CHdva)3CHdvaCl + SOdva + HCl
Tato reakce odpovídá halogenaci 1-pentanolu za vzniku 1-chlorpentanu v přítomnosti pyridinu.
Oxidace primárních alkoholů
Alkoholy mohou být oxidovány na aldehydy a karboxylové kyseliny, v závislosti na činidle. Pyridiniumchlorchroman (PCC) oxiduje primární alkohol na aldehyd pomocí dichlormethanu (CHdvaCldva):
CH3(CHdva)5CHdvaOH => CH3(CHdva)5COH
Jedná se o oxidaci 1-heptanolu na 1-heptanal.
Mezitím manganistan draselný (KMnO4) nejprve oxiduje alkohol na aldehyd a poté oxiduje aldehyd na karboxylovou kyselinu. Pokud se k oxidaci alkoholů používá manganistan draselný, je třeba zabránit rozbití vazby mezi uhlíky 3 a 4..
CH3(CHdva)4CHdvaOH => CH3(CHdva)4COOH
Jedná se o oxidaci 1-hexanolu na kyselinu hexanovou.
Tímto způsobem je obtížné získat aldehyd, protože se snadno oxiduje na karboxylovou kyselinu. Podobná situace je pozorována při použití kyseliny chromové k oxidaci alkoholů.
Tvorba etherů
Primární alkoholy lze převést na ethery, když se zahřívají v přítomnosti katalyzátoru, obvykle kyseliny sírové:
2 RCHdvaOH => RCHdvaOCHdvaR + HdvaNEBO
Tvorba organických esterů
Kondenzací alkoholu a karboxylové kyseliny, Fisherovou esterifikací, katalyzovanou kyselinou, vznikne ester a voda:
R'OH + RCOOH <=> RCOOR '+ HdvaNEBO
Dobře známou reakcí je reakce ethanolu s kyselinou octovou, čímž se získá ethylacetát:
CH3CHdvaOH + CH3COOH <=> CH3COOHCHdvaCH3 + HdvaNEBO
Primární alkohol je nejvíce citlivý na Fischerovy esterifikační reakce.
Dehydratace
Při vysokých teplotách a v kyselém prostředí, obvykle kyselině sírové, se alkoholy dehydratují za vzniku alkenů se ztrátou molekuly vody.
CH3CHdvaOH => HdvaC = CHdva + HdvaNEBO
Toto je dehydratační reakce ethanolu na ethylen. Vhodnější obecný vzorec pro tento typ reakce, konkrétně pro primární alkohol, by byl:
RCHdvaOH => R = CHdva (což se také rovná RC = CHdva)
Nomenklatura
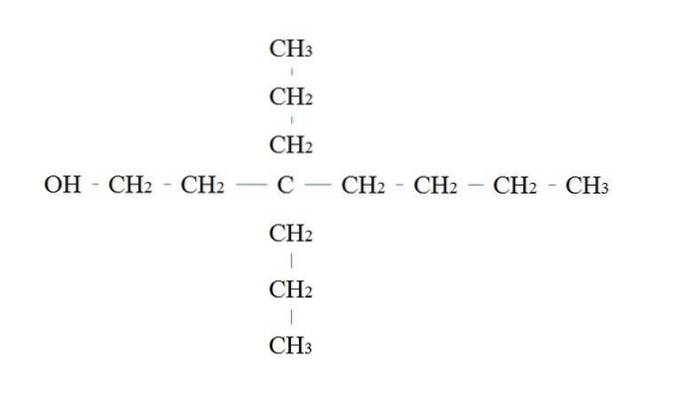
Pravidla pro pojmenování primárního alkoholu jsou stejná jako pro ostatní alkoholy; s tou výjimkou, že někdy není nutné uvádět uhlík nesoucí OH.
Na horním obrázku je hlavní řetězec se sedmi uhlíky. Uhlíku vázaného na OH je přiřazeno číslo 1 a poté se začne počítat zleva doprava. Jeho název podle IUPAC je: 3,3-diethylheptanol.
Toto je příklad vysoce rozvětveného primárního alkoholu.
Příklady
Nakonec jsou zmíněny některé primární alkoholy na základě jejich tradiční a systematické nomenklatury:
-Methyl, CH3Ach
-Ethyl, CH3CHdvaAch
-n-propyl, CH3CHdvaCHdvaAch
-n-hexyl, CH3CHdvaCHdvaCHdvaCHdvaCHdvaAch
Jedná se o deriváty lineárních alkanů. Další příklady jsou:
-2-fenyletanol, C6H5CHdvaCHdvaOH (C.6H5 = benzenový kruh)
-2-propen-1-ol (allylalkohol), CHdva= CHCHdvaAch
-1,2-etandiol, CHdvaOHCHdvaAch
-2-chlorethanol (ethylenchlorhydrin), ClCHdvaCHdvaAch
-2-buten-1-ol (krotylalkohol), CH3CH = CHCHdvaAch
Reference
- Morrison, R.T. a Boyd, R. N. (1987). Organická chemie. (5ta Edice). Addison-Wesley Iberoamericana
- Carey, F. A. (2008). Organická chemie. (6ta Edice). McGraw-Hill, Interamerica, Editores S.A.
- Mel Science. (2019). Jak probíhá oxidace primárních alkoholů. Obnoveno z: melscience.com
- Royal Society of Chemistry. (2019). Definice: primární alkoholy. Obnoveno z: rsc.org
- Chriss E. McDonald. (2000). Oxidace primárních alkoholů na estery: tři související vyšetřovací experimenty. J. Chem. Educ., 2000, 77 (6), s. 750. DOI: 10.1021 / ed077p750


Zatím žádné komentáře