
Struktura oxidu siřičitého (SO3), vlastnosti, rizika, použití

The oxid sírový Je to anorganická sloučenina vytvořená spojením atomu síry (S) a 3 atomů kyslíku (O). Jeho molekulární vzorec je SO3. Při pokojové teplotě SO3 je to kapalina, která uvolňuje plyny do vzduchu.
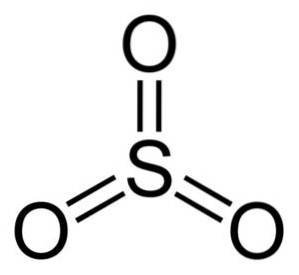
Struktura OS3 plynný je plochý a symetrický. Všechny tři kyslíky jsou rovnoměrně umístěny kolem síry. SO3 Prudce reaguje s vodou. Reakce je exotermická, což znamená, že se produkuje teplo, jinými slovy, velmi se zahřívá.
Když SO3 kapalina se ochladí, změní se na pevnou látku, která může mít tři typy struktur: alfa, beta a gama. Nejstabilnější je alfa, ve formě vrstev spojených dohromady tvořících síť.
Plynný oxid sírový se používá k přípravě dýmavé kyseliny sírové, nazývané také oleum, kvůli své podobnosti s olejem nebo olejovými látkami. Další z jeho důležitých aplikací je při sulfonaci organických sloučenin, tj. Přidání -SO skupin3- k nim. Lze tedy připravit užitečné chemikálie, jako jsou detergenty, barviva, pesticidy..
SO3 Je velmi nebezpečný, může způsobit těžké popáleniny, poškození očí a kůže. Neměl by být ani inhalován nebo požit, protože může způsobit smrt při vnitřních popáleninách, v ústech, jícnu, žaludku atd..
Z těchto důvodů je nutné s ním zacházet velmi opatrně. Nikdy by neměl přijít do styku s vodou nebo hořlavými materiály, jako je dřevo, papír, látky atd., Protože by mohlo dojít k požáru. Z důvodu nebezpečí výbuchu by neměl být zlikvidován ani vniknout do kanalizace.
SO3 Plynné látky vznikající v průmyslových procesech by se neměly uvolňovat do životního prostředí, protože je to jeden z těch, kdo jsou zodpovědní za kyselé deště, které již poškodily velké plochy lesů na světě.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Trojitý bod
- 3.5 Bod varu
- 3.6 Hustota
- 3.7 Tlak par
- 3.8 Stabilita
- 4 Chemické vlastnosti
- 5 Získání
- 6 použití
- 6.1 Při přípravě oleum
- 6.2 Při sulfonačních chemických reakcích
- 6.3 Při těžbě kovů
- 6.4 V různých použitích
- 7 Rizika
- 7.1 Pro zdraví
- 7.2 Z ohně nebo výbuchu
- 8 Dopad na životní prostředí
- 9 Odkazy
Struktura
Molekula oxidu siřičitého SO3 v plynném stavu má plochou trojúhelníkovou strukturu.
To znamená, že jak síra, tak tři kyslíky jsou ve stejné rovině. Kromě toho je distribuce kyslíků a všech elektronů symetrická.
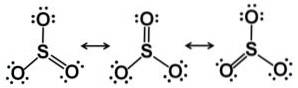
V pevném stavu jsou známy tři typy struktury SO3: alfa (α-SO3), beta (β-SO3) a gama (γ-SO.)3).
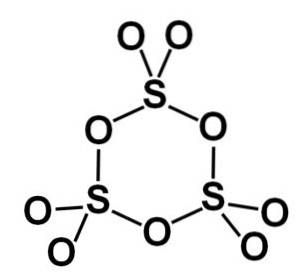
Forma gama y-SO3 obsahuje cyklické trimery, tj. tři jednotky SO3 společně tvoří cyklickou nebo kruhovou molekulu.
Fáze beta β-SO3 má nekonečné spirálovité řetězce čtyřstěnů složení SO4 propojeny dohromady.
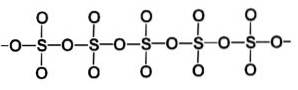
Nejstabilnější formou je alfa α-SO3, podobný beta, ale s vrstvenou strukturou, s řetězy spojenými do sítě.
Nomenklatura
-Oxid siřičitý
-Anhydrid kyseliny sírové
-Oxid siřičitý
-SW3 gama, γ-SO3
-SW3 beta, β-SO3
-SW3 alfa, α-SO3
Fyzikální vlastnosti
Fyzický stav
Při pokojové teplotě (kolem 25 ° C) a atmosférickém tlaku, SO3 je to bezbarvá kapalina, která vydává výpary do vzduchu.
Když SO3 kapalina je čistá při 25 ° C, je to směs SO3 monomerní (jedna molekula) a trimerní (3 připojené molekuly) vzorce S3NEBO9, nazývané také SO3 gama γ-SO3.
Jak teplota klesá, pokud SO3 je čistý, když dosáhne 16,86 ° C, ztuhne nebo zamrzne na γ-SO3, nazývané také „SO ice3".
Pokud obsahuje malé množství vlhkosti (dokonce stopy nebo extrémně malé množství), SO3 polymeruje na formu beta β-SO3 který vytváří krystaly s hedvábným leskem.
Poté se vytvoří více vazeb, které generují alfa-SO strukturu3, což je krystalická pevná látka ve tvaru jehly, která připomíná azbest nebo azbest.
Při sloučení alfa a beta generují gama.
Molekulární váha
80,07 g / mol
Bod tání
SW3 gama = 16,86 ° C
Trojitý bod
Je to teplota, při které jsou přítomny tři fyzikální stavy: pevná látka, kapalina a plyn. V alfa formě je trojitý bod při 62,2 ° C a v beta verzi je to 32,5 ° C.
Zahřívání alfa formy má větší tendenci sublimovat než tát. Sublimovat znamená přejít z pevného stavu do plynného přímo, aniž byste prošli kapalným stavem.
Bod varu
Všechny formy OS3 vařte při 44,8 ° C.
Hustota
SO3 kapalina (gama) má hustotu 1,9225 g / cm3 při 20 ° C.
SO3 plyn má hustotu 2,76 ve vztahu ke vzduchu (vzduch = 1), což naznačuje, že je těžší než vzduch.
Tlak páry
SW3 alfa = 73 mm Hg při 25 ° C
SW3 beta = 344 mm Hg při 25 ° C
SW3 gama = 433 mm Hg při 25 ° C
To znamená, že gama forma má tendenci se odpařovat snadněji než beta a tato než alfa..
Stabilita
Alfa forma je nejstabilnější struktura, ostatní jsou metastabilní, to znamená, že jsou méně stabilní.
Chemické vlastnosti
SO3 reaguje prudce s vodou za vzniku kyseliny sírové HdvaSW4. Při reakci vzniká velké množství tepla, a proto se ze směsi rychle uvolňuje vodní pára.
Být vystaven vzduchu SO3 rychle absorbuje vlhkost a vydává husté páry.
Jedná se o velmi silné dehydratační činidlo, což znamená, že snadno odstraňuje vodu z jiných materiálů.
Síra v SO3 má afinitu k volným elektronům (tj. elektronům, které nejsou ve vazbě mezi dvěma atomy), takže má sklon vytvářet komplexy se sloučeninami, které je obsahují, jako je pyridin, trimethylamin nebo dioxan.
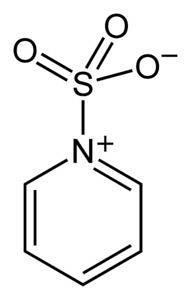
Vytvářením komplexů si síra „vypůjčuje“ elektrony od druhé sloučeniny, aby zaplnila její nedostatek. V těchto komplexech, které se používají při chemických reakcích k získání SO, je stále k dispozici oxid sírový3.
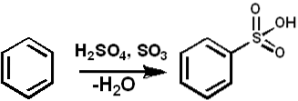
Jedná se o silné sulfonanční činidlo pro organické sloučeniny, což znamená, že se používá ke snadnému přidání skupiny -SO3- na molekuly.
Snadno reaguje s oxidy mnoha kovů za vzniku síranů těchto kovů.
Je korozivní pro kovy, živočišné a rostlinné tkáně.
SO3 Je obtížné s ním manipulovat z několika důvodů: (1) jeho bod varu je relativně nízký, (2) má sklon k tvorbě pevných polymerů při teplotách pod 30 ° C a (3) má vysokou reaktivitu téměř ke všem organickým látkám látky a voda.
Může obsahovat výbušninu, pokud neobsahuje stabilizátor a je přítomna vlhkost. Jako stabilizátory se používají dimethylsulfát nebo oxid boritý..
Získávání
Získává se reakcí mezi oxidem siřičitým SO při teplotě 400 ° Cdva a molekulární kyslík Odva. Reakce je však velmi pomalá a ke zvýšení rychlosti reakce jsou zapotřebí katalyzátory..
2 SOdva + NEBOdva ⇔ 2 SO3
Mezi sloučeniny, které urychlují tuto reakci, patří platinový kov Pt, oxid vanaditý VdvaNEBO5, oxid železitý FedvaNEBO3 a oxid dusnatý NO.
Aplikace
Při přípravě oleum
Jednou z jeho hlavních aplikací je příprava oleum nebo dýmavá kyselina sírová, tzv. Protože emituje páry viditelné pouhým okem. K jeho získání se SO absorbuje3 v koncentrované kyselině sírové HdvaSW4.

To se provádí ve speciálních věžích z nerezové oceli, kde koncentrovaná kyselina sírová (která je kapalná) klesá a SO3 soda stoupá.
Kapalina a plyn přicházejí do styku a spojují se a vytvářejí oleum, což je olejovitá kapalina. To má směs HdvaSW4 A tak3, ale má také molekuly kyseliny disulfurové HdvaSdvaNEBO7 a trisulfuric HdvaS3NEBO10.
Při sulfonačních chemických reakcích
Sulfonace je klíčovým procesem ve velkých průmyslových aplikacích pro výrobu detergentů, povrchově aktivních látek, barviv, pesticidů a farmaceutik..
SO3 slouží jako sulfonační činidlo k přípravě sulfonovaných olejů a alkyl-aryl-sulfonovaných detergentů, mezi mnoha jinými sloučeninami. Následující ukazuje sulfonační reakce aromatické sloučeniny:
ArH + SO3 → ArSO3H
Oleum nebo SO lze použít pro sulfonační reakce.3 ve formě svých komplexů s pyridinem nebo mimo jiné s trimethylaminem.
Při těžbě kovů
SO plyn3 Používá se při léčbě minerálů. Jednoduché oxidy kovů se mohou stát mnohem rozpustnějšími sulfáty zpracováním s SO3 při relativně nízkých teplotách.
Sulfidové minerály, jako je pyrit (sulfid železitý), chalkosin (sulfid měďnatý) a millerit (sulfid nikelnatý), jsou nejekonomičtějšími zdroji neželezných kovů, proto zpracování SO3 umožňuje tyto kovy snadno a levně získat.
Sulfidy železa, niklu a mědi reagují s plynným SO3 dokonce při pokojové teplotě tvoří příslušné sulfáty, které jsou velmi rozpustné a mohou být podrobeny jiným procesům za účelem získání čistého kovu.
V různých použitích
SO3 používá se k přípravě kyseliny chlorsírové také nazývané kyselina chlorosulfonová HSO3Cl.
Oxid siřičitý je velmi silný oxidant a používá se při výrobě výbušnin..
Rizika
Na zdraví
SO3 Jedná se o vysoce toxickou sloučeninu všemi způsoby, tj. Inhalací, požitím a kontaktem s pokožkou.
Dráždí a koroduje sliznice. Způsobuje poleptání kůže a očí. Jeho páry jsou při vdechování velmi toxické. Objevují se vnitřní popáleniny, dušnost, bolesti na hrudi a plicní edém.

Je to jedovaté. Při jeho požití dochází k těžkým popáleninám úst, jícnu a žaludku. Kromě toho existuje podezření, že je karcinogenní.
Z ohně nebo výbuchu
Představuje nebezpečí požáru při kontaktu s materiály organického původu, jako jsou dřevo, vlákna, papír, olej, bavlna, mimo jiné, zejména pokud jsou mokré..
Riziko existuje také při kontaktu s bázemi nebo redukčními činidly. Kombinuje se s vodou výbušně a tvoří kyselinu sírovou.
Při kontaktu s kovy může vznikat plynný vodík Hdva což je velmi hořlavé.
Je třeba se vyhnout ohřívání ve skleněných nádobách, aby se zabránilo možnému násilnému prasknutí nádoby..
Zásah do životního prostředí
SO3 Je považován za jednu z hlavních znečišťujících látek přítomných v zemské atmosféře. To je způsobeno jeho rolí při tvorbě aerosolů a jeho příspěvkem ke kyselým dešťům (kvůli tvorbě kyseliny sírové HdvaSW4).

SO3 vzniká v atmosféře oxidací oxidu siřičitého SOdva. Při vytváření SO3 rychle reaguje s vodou za vzniku kyseliny sírové HdvaSW4. Podle nedávných studií existují další mechanismy transformace SO3 v atmosféře, ale vzhledem k velkému množství vody přítomné v něm se stále považuje za mnohem pravděpodobnější SO3 stává se primárně HdvaSW4.
SO3 Plyn nebo plynný průmyslový odpad, který je obsahuje, by neměl být vypouštěn do ovzduší, protože je to nebezpečná znečišťující látka. Je to vysoce reaktivní plyn a, jak již bylo řečeno dříve, v přítomnosti vlhkosti ve vzduchu, SO3 se stává kyselinou sírovou HdvaSW4. Proto ve vzduchu SO3 přetrvává ve formě kyseliny sírové a tvoří malé kapičky nebo aerosol.
Pokud kapičky kyseliny sírové proniknou do dýchacích cest lidí nebo zvířat, jejich přítomnost vlhkosti rychle roste, takže mají šanci proniknout do plic. Jeden z mechanismů, kterým kyselá mlha HdvaSW4 (tj. SO3) může způsobit silnou toxicitu, protože mění extracelulární a intracelulární pH živých organismů (rostlin, zvířat a lidí).
Podle některých výzkumníků mlha z SO3 Je příčinou nárůstu astmatiků v oblasti Japonska. SO mlha3 Působí velmi korozivně na kovy, takže kovové konstrukce postavené lidmi, jako jsou některé mosty a budovy, mohou být vážně ovlivněny..
SO3 Kapalina by se neměla vyhazovat do kanalizace nebo kanalizace. V případě rozlití do kanalizace může dojít k požáru nebo výbuchu. Pokud dojde k náhodnému rozlití, nesměřujte na výrobek proud vody. Nikdy by neměl být absorbován pilinami nebo jinými hořlavými absorbenty, protože by mohl způsobit požár.
Musí být absorbován suchým pískem, suchou zemí nebo jiným zcela suchým inertním absorbentem. SO3 Neměl by se uvolňovat do životního prostředí a nikdy by se s ním nemělo přijít do styku. Mělo by být chráněno před vodními zdroji, protože tím produkuje kyselinu sírovou, která je škodlivá pro vodní a suchozemské organismy.
Reference
- Sarkar, S. a kol. (2019). Vliv amoniaku a vody na osud oxidu sírového v troposféře: Teoretické zkoumání cest tvorby kyseliny sírové a kyseliny sírové. J Phys Chem A. 2019; 123 (14): 3131-3141. Obnoveno z ncbi.nlm.nih.gov.
- Muller, T.L. (2006). Kyselina sírová a oxid sírový. Kirk-Othmer Encyclopedia of Chemical Technology. Svazek 23. Obnoveno z onlinelibrary.wiley.com.
- NÁS. Národní lékařská knihovna. (2019). Oxid siřičitý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Kikuchi, R. (2001). Environmentální management emisí oxidu siřičitého: Dopad SO3 o lidském zdraví. Environmental Management (2001) 27: 837. Obnoveno z odkazu.springer.com.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Ismail, M.I. (1979). Těžba kovů ze sulfidů pomocí oxidu siřičitého ve fluidním loži. J. Chem. Tech. Biotechnol. 1979, 29, 361-366. Obnoveno z onlinelibrary.wiley.com.

Zatím žádné komentáře