
Struktura, vlastnosti, nomenklatura a použití alkoholů
The alkoholy jsou to organické sloučeniny, které se vyznačují tím, že mají hydroxylovou skupinu (-OH) navázanou na nasycený uhlík; tj. uhlík, který je spojen se čtyřmi atomy jednoduchými vazbami (bez dvojných nebo trojných vazeb).
Obecným vzorcem pro tuto rozsáhlou a všestrannou rodinu sloučenin je ROH. Aby byl považován za alkohol v přísně chemickém smyslu, musí být skupina OH nejreaktivnější v molekulární struktuře. To je důležité, aby bylo možné mezi několika molekulami s OH skupinami potvrdit, který z nich je alkohol..

Jedním z podstatných alkoholů a nejznámějším v populární kultuře je ethylalkohol nebo ethanol, CH3CHdvaACH. V závislosti na jejich přirozeném původu, a tedy na jejich chemickém prostředí, mohou jejich směsi pocházet z neomezeného spektra příchutí; některé dokonce vykazují pozitivní změny na patře s létáním let.
Jsou to směsi organických a anorganických sloučenin s ethylalkoholem, což vede k jeho spotřebě při společenských a náboženských událostech od dob před Kristem; například s hroznovým vínem nebo se skleničkami podávanými na oslavu, kromě razníků, bonbónů, panettonů atd..
Požitek z těchto nápojů, s mírou, je výsledkem synergie mezi ethylalkoholem a jeho obklopující chemickou matricí; bez ní se jako čistá látka stává extrémně nebezpečnou a vyvolává řadu negativních zdravotních důsledků.
Z tohoto důvodu je spotřeba vodných směsí CH3CHdvaOH, stejně jako léky zakoupené v lékárnách pro antiseptické účely, představuje pro tělo velké riziko.
Mezi další velmi oblíbené alkoholy patří také mentol a glycerol. Ten druhý, stejně jako erytrol, se nachází jako přísada v mnoha potravinách, aby je osladil a konzervoval během skladování. Existují vládní subjekty, které určují, které alkoholy mohou být použity nebo konzumovány bez vedlejších účinků..
Necháme-li za sebou každodenní používání alkoholů, jsou to chemicky velmi univerzální látky, protože z nich lze syntetizovat další organické sloučeniny; do té míry, že si někteří autoři myslí, že s tuctem z nich lze vytvořit všechny potřebné sloučeniny pro život na pustém ostrově.
Rejstřík článků
- 1 Struktura alkoholů
- 1.1 Amfifilní charakter
- 1.2 Struktura R.
- 2 Fyzikální a chemické vlastnosti
- 2.1 Bod varu
- 2.2 Kapacita rozpouštědla
- 2.3 Amfoterismus
- 3 Názvosloví
- 3.1 Obecný název
- 3.2 Systém IUPAC
- 4 Syntéza
- 4.1 Hydratace alkenů
- 4.2 Proces Oxo
- 4.3 Fermentace sacharidů
- 5 použití
- 5.1 Nápoje
- 5.2 Chemická surovina
- 5.3 Rozpouštědla
- 5.4 Paliva
- 5.5 Antiseptika
- 5.6 Jiná použití
- 6 Reference
Struktura alkoholů
Alkoholy mají obecný vzorec ROH. OH skupina je navázána na alkylovou skupinu R, jejíž struktura se liší od jednoho alkoholu k druhému. Spojení mezi R a OH je prostřednictvím jediné kovalentní vazby, R-OH.
Následující obrázek ukazuje tři obecné struktury pro alkoholy, přičemž je třeba mít na paměti, že atom uhlíku je nasycený; to znamená, že tvoří čtyři jednoduché odkazy.
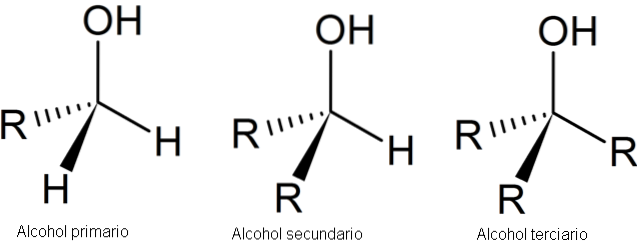
Jak je vidět, R může být jakýkoli uhlíkový skelet, pokud nemá substituenty reaktivnější než OH skupina..
V případě primárního alkoholu 1. je skupina OH navázána na primární uhlík. To lze snadno ověřit pozorováním, že atom ve středu levého čtyřstěnu je navázán na jeden R a dva H.
Sekundární alkohol, 2º, je ověřen uhlíkem čtyřstěnu ve středu, který je nyní spojen se dvěma skupinami R a jednou H.
A konečně je tu terciární alkohol, 3 °, s uhlíkem spojeným se třemi skupinami R..
Amfifilní charakter
V závislosti na typu uhlíku vázaného na OH existuje klasifikace primárních, sekundárních a terciárních alkoholů. V čtyřstěnech byly strukturální rozdíly mezi nimi již podrobně popsány. Ale všechny alkoholy, bez ohledu na jejich strukturu, mají něco společného: amfifilní charakter..
Abyste si toho všimli, nemusíte řešit strukturu, stačí její chemický vzorec ROH. Alkylová skupina je tvořena téměř výhradně z atomů uhlíku a „sestavuje“ hydrofobní páteř; to znamená, že interaguje velmi slabě s vodou.
Na druhou stranu může skupina OH tvořit vodíkové vazby s molekulami vody, a tak být hydrofilní; to znamená, že miluje nebo má spříznění s vodou. Alkoholy tedy mají hydrofobní páteř připojenou k hydrofilní skupině. Jsou nepolární a polární zároveň, což je totéž jako říkat, že jsou to amfifilní látky.
R-OH
(Hydrofobní) - (hydrofilní)
Jak bude vysvětleno v následující části, amfifilní charakter alkoholů definuje některé jejich chemické vlastnosti..
Struktura R.
Alkylová skupina R může mít jakoukoli strukturu, a přesto je to důležité, protože umožňuje katalogizaci alkoholů.
Například R může být otevřený řetězec, jako je tomu v případě ethanolu nebo propanolu; rozvětvený, jako je t-butylalkohol, (CH3)dvaCHCHdvaACH; může to být cyklické, jako v případě cyklohexanolu; nebo může mít aromatický kruh, jako v benzylalkoholu, (C6H5) CHdvaOH nebo v 3-fenylpropanolu (C.6H5) CHdvaCHdvaCHdvaAch.
Řetězec R může dokonce obsahovat substituenty, jako jsou halogeny nebo dvojné vazby, například pro alkoholy 2-chlorethanol a 2-buten-1-ol (CH3CHdva= CHCHdvaACH).
S ohledem na strukturu R se klasifikace alkoholů stává složitou. Z tohoto důvodu je klasifikace na základě jejich struktury (1., 2. a 3. alkohol) jednodušší, ale méně konkrétní, i když stačí vysvětlit reaktivitu alkoholů..
Fyzikální a chemické vlastnosti
Bod varu
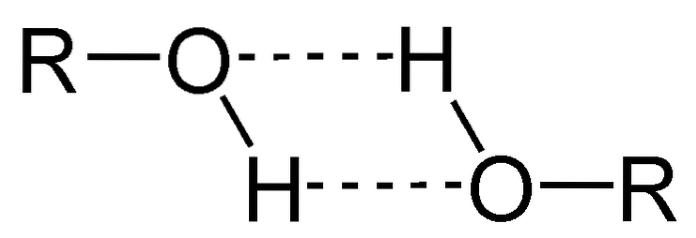
Jednou z hlavních vlastností alkoholů je, že se sdružují prostřednictvím vodíkových vazeb.
Na obrázku výše můžete vidět, jak dvě molekuly ROH tvoří mezi sebou vodíkové vazby. Díky tomu jsou alkoholy obvykle kapaliny s vysokou teplotou varu..
Například ethylalkohol má teplotu varu 78,5 ° C. Tato hodnota se zvyšuje s rostoucím obsahem alkoholu; to znamená, že skupina R má větší hmotnost nebo počet atomů. Tedy n-butylalkohol, CH3CHdvaCHdvaCHdvaOH, má teplotu varu 97 ° C, o něco nižší než voda.
Glycerol je jeden z alkoholů s nejvyšší teplotou varu: 290 ° C.
Proč? Protože nejen hmota nebo struktura R ovlivňuje, ale také počet OH skupin. Glycerol má ve své struktuře tři OH: (HO) CHdvaCH (OH) CHdva(ACH). Díky tomu je schopen vytvářet mnoho vodíkových vazeb a pevněji držet své molekuly pohromadě..
Na druhou stranu, některé alkoholy jsou pevné pokojová teplota; jako stejný glycerol při teplotě pod 18 ° C. Proto je tvrzení, že všechny alkoholy jsou kapalné látky, nesprávné..
Kapacita rozpouštědla
V domácnostech je velmi běžné uchýlit se k odstranění isopropylalkoholu k odstranění skvrn, které je obtížné odstranit na povrchu. Tato kapacita rozpouštědla, velmi užitečná pro chemickou syntézu, je dána jeho amfifilním charakterem, který byl dříve vysvětlen.
Tuky se vyznačují tím, že jsou hydrofobní: proto je obtížné je odstranit vodou. Na rozdíl od vody však mají alkoholy ve své struktuře hydrofobní část.
Jeho alkylová skupina R tedy interaguje s tuky, zatímco skupina OH vytváří vodíkové vazby s vodou a pomáhá je vytěsňovat..
Amfoterismus
Alkoholy mohou reagovat jako kyseliny a zásady; to znamená, že jsou to amfoterní látky. To je reprezentováno následujícími dvěma chemickými rovnicemi:
ROH + H+ => ROHdva+
ROH + OH- => RO-
RO- je obecný vzorec toho, co je známé jako alkoxid.
Nomenklatura
Existují dva způsoby, jak pojmenovat alkoholy, jejichž složitost bude záviset na jejich struktuře.
Běžné jméno
Alkoholy lze nazvat běžnými jmény. Což jsou? Za tímto účelem musí být známý název skupiny R, ke kterému se přidává koncovka -ico, a před ním je slovo „alkohol“. Například CH3CHdvaCHdvaOH je propylalkohol.
Další příklady jsou:
-CH3OH: methylalkohol
-(CH3)dvaCHCHdvaOH: isobutylalkohol
-(CH3)3COH: terc-butylalkohol
Systém IUPAC
Pokud jde o běžná jména, musíte začít identifikováním R. Výhodou tohoto systému je, že je mnohem přesnější než ten druhý..
R, který je uhlíkovou kostrou, může mít větve nebo několik řetězců; nejdelší řetězec, tj. s více atomy uhlíku, je ten, který bude mít název alkoholu.
Ke jménu alkanu nejdelšího řetězce se přidává koncovka „l“. Proto v CH3CHdvaOH se nazývá ethanol (CH3CHdva- + ACH).
Obecně by měl mít OH nejnižší možný výčet. Například BrCHdvaCHdvaCHdva(OH) CH3 se nazývá 4-brom-2-butanol, a nikoli 1-brom-3-butanol.
Syntéza
Alkenová hydratace
Proces krakování ropy vytváří směs alkenů se čtyřmi nebo pěti atomy uhlíku, které lze snadno oddělit.
Tyto alkeny lze převést na alkoholy přímým přidáním vody nebo reakcí alkenu s kyselinou sírovou, po které následuje přidání vody, která štěpí kyselinu za vzniku alkoholu..
Oxo proces
V přítomnosti vhodného katalyzátoru reagují alkeny s oxidem uhelnatým a vodíkem za vzniku aldehydů. Aldehydy lze snadno redukovat na alkoholy katalytickou hydrogenační reakcí.
Často dochází k takové synchronizaci oxo procesu, že redukce aldehydů probíhá téměř současně s jejich tvorbou..
Nejpoužívanějším katalyzátorem je dikobalt oktokarbonyl, získaný reakcí mezi kobaltem a oxidem uhelnatým.
Kvašení sacharidů
Kvašení sacharidů kvasinkami má stále velký význam při výrobě ethanolu a dalších alkoholů. Cukry pocházejí z cukrové třtiny nebo škrobu získaného z různých zrn. Z tohoto důvodu se ethanolu také říká „obilný alkohol“
Aplikace
Nápoje
Ačkoli to není hlavní funkcí alkoholů, přítomnost ethanolu v některých nápojích je jednou z nejoblíbenějších znalostí. Ethanol, produkt fermentace cukrové třtiny, hroznů, jablek atd., Je tedy přítomen v mnoha nápojích pro společenskou spotřebu.
Chemická surovina
-Metanol se používá při výrobě formaldehydu prostřednictvím jeho katalytické oxidace. Formaldehyd se používá při výrobě plastů, barev, textilií, výbušnin atd..
-Butanol se používá při výrobě butan-ethanoátu, esteru používaného jako aromata v potravinářském a cukrářském průmyslu..
-Allylalkohol se používá při výrobě esterů, včetně dialylftalátu a dialylisoftalátu, které slouží jako monomery.
-Fenol se používá při výrobě pryskyřic, výrobě nylonu, deodorantů, kosmetiky atd..
-Jako meziprodukty k získání změkčovadel se používají alkoholy s přímým řetězcem 11-16 atomů uhlíku; například polyvinylchlorid.
-Takzvané mastné alkoholy se používají jako meziprodukty při syntéze detergentů.
Rozpouštědla
-Jako ředidlo nátěru se používá methanol, stejně jako 1-butanol a isobutylalkohol.
-Ethylalkohol se používá jako rozpouštědla pro mnoho sloučenin nerozpustných ve vodě a používá se jako rozpouštědlo v barvách, kosmetice atd..
-Mastné alkoholy se používají jako rozpouštědla v textilním průmyslu, v barvivech, detergentech a barvách. Isobutanol se používá jako rozpouštědlo v nátěrových hmotách, barvách a lepidlech.
Paliva
-Metanol se používá jako palivo ve spalovacích motorech a aditivum do benzinu ke zlepšení spalování.
-Ethylalkohol se používá v kombinaci s fosilními palivy v motorových vozidlech. Za tímto účelem jsou rozsáhlé oblasti Brazílie předurčeny k pěstování cukrové třtiny pro výrobu ethylalkoholu. Výhodou tohoto alkoholu je, že při svém spalování produkuje pouze oxid uhličitý..
Při spalování ethylalkoholu vzniká čistý bezdýmný plamen, a proto se v polních kuchyních používá jako palivo..
-Gélový alkohol se vyrábí kombinací methanolu nebo ethanolu s octanem vápenatým. Tento alkohol se používá jako zdroj tepla v kamenných kamenech, a protože se rozlije, je bezpečnější než kapalné alkoholy.
-Takzvaný biobutanol se používá jako palivo v dopravě, stejně jako isopropylalkohol, který lze použít jako palivo; i když se jeho použití nedoporučuje.
Antiseptika
Isopropylalkohol v 70% koncentraci se používá jako externí antiseptikum k eliminaci choroboplodných zárodků a zpomalení jejich růstu. Podobně se pro tento účel používá ethylalkohol..
Jiná použití
Cyklohexanol a methylcyklohexanol se používají při dokončování textilu, zpracování nábytku a odstraňování skvrn.
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Morrison a Boyd. (1987). Organická chemie. (Páté vydání). Addison-Wesley Iberoamericana.
- Dr. JA Colapret. (s.f.). Alkoholy. Obnoveno z: colapret.cm.utexas.edu
- Partnerství pro výchovu k farmakologické farmakologii alkoholu. (s.f.). Co je to alkohol? Duke University. Obnoveno z: sites.duke.edu
- Whittemore F. (s.f.). Druhy a použití alkoholu. Obnoveno z: livestrong.com
- Wikipedia. (2018). Alkohol. Obnoveno z: en.wikipedia.org



Zatím žádné komentáře