
Struktura aldehydů, vlastnosti, použití a příklady

The aldehydy jsou to organické sloučeniny, které mají obecný vzorec RCHO. R představuje alifatický nebo aromatický řetězec; C na uhlík; O na kyslík a H na vodík. Vyznačují se karbonylovou skupinou, jako jsou ketony a karboxylové kyseliny, a proto se aldehydy také nazývají karbonylové sloučeniny.
Karbonylová skupina dává aldehydu mnoho jeho vlastností. Jsou to sloučeniny, které se snadno oxidují a jsou velmi reaktivní na nukleofilní adice. Dvojná vazba karbonylové skupiny (C = O) má dva atomy, které mají rozdíly v jejich chamtivosti po elektronech (elektronegativita).
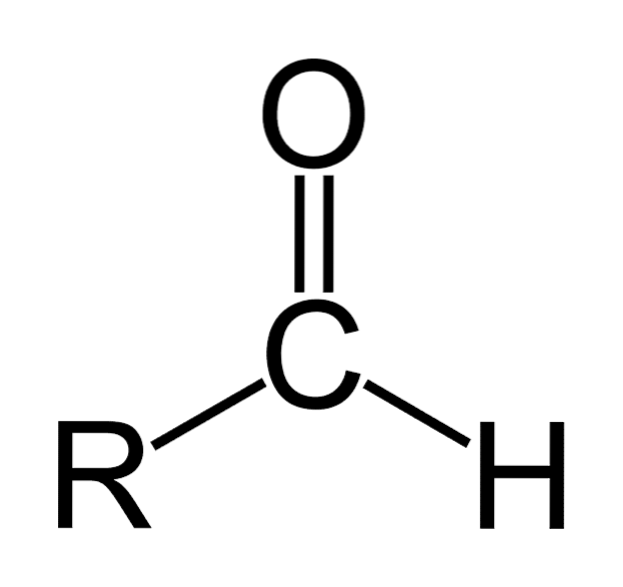
Kyslík přitahuje elektrony větší silou než uhlík, takže se elektronový mrak pohybuje směrem k němu, čímž je dvojná vazba mezi uhlíkem a kyslíkem polární v přírodě, s významným dipólovým momentem. Tím se aldehydy stanou polárními sloučeninami..
Polarita aldehydů ovlivní jejich fyzikální vlastnosti. Bod varu a rozpustnost aldehydů ve vodě jsou vyšší než u nepolárních chemických sloučenin s podobnými molekulovými hmotnostmi, jako je tomu v případě uhlovodíků..
Aldehydy s méně než pěti atomy uhlíku jsou rozpustné ve vodě, protože mezi kyslíkem karbonylové skupiny a molekulou vody se tvoří vodíkové vazby. Zvyšování počtu uhlíků v uhlovodíkovém řetězci však vede ke zvýšení nepolární části aldehydu, čímž je méně rozpustný ve vodě..
Ale jaké jsou a odkud pocházejí? Ačkoli jeho podstata v podstatě závisí na karbonylové skupině, zbytek molekulární struktury také hodně přispívá k celku. Mohou tedy být jakékoli velikosti, malé i velké, nebo dokonce makromolekula může mít oblasti, kde převažuje charakter aldehydů..
Stejně jako u všech chemických sloučenin tedy existují „příjemné“ aldehydy a jiné hořké. Mohou být nalezeny v přírodních zdrojích nebo syntetizovány ve velkém měřítku. Příklady aldehydů jsou vanilin, velmi přítomný ve zmrzlinách (horní obrázek), a acetaldehyd, který dodává chuť alkoholickým nápojům..
Rejstřík článků
- 1 Chemická struktura
- 2 Fyzikální a chemické vlastnosti
- 2.1 Body tání
- 2.2 Body varu
- 2.3 Rozpustnost ve vodě vyjádřená v g / 100 g H2O
- 3 Reaktivita
- 3.1 Oxidační reakce
- 3.2 Redukce na alkoholy
- 3.3 Redukce na uhlovodíky
- 3.4 Nukleofilní přidání
- 4 Názvosloví
- 5 použití
- 5.1 Formaldehyd
- 5.2 Bakelit
- 5.3 Překližka
- 5.4 Polyuretan
- 5.5 Butyraldehyd
- 5.6 Acetaldehyd
- 5.7 Syntéza
- 6 Příklady aldehydů
- 6.1 Glutaraldehyd
- 6.2 Benzaldehyd
- 6.3 Glyceraldehyd
- 6.4 Glyceraldehyd-3-fosfát
- 6,5 11-cis-retinal
- 6.6 Pyridoxal fosfát (vitamin B6)
- 6.7 Salicylaldehyd
- 7 Reference
Chemická struktura

Aldehydy sestávají z karbonylu (C = O), ke kterému je přímo připojen atom vodíku. Tím se odlišuje od jiných organických sloučenin, jako jsou ketony (R.dvaC = O) a karboxylové kyseliny (RCOOH).
Horní obrázek ukazuje molekulární strukturu kolem -CHO, formylové skupiny. Formylová skupina je plochá, protože uhlík a kyslík mají sp hybridizacidva. Díky této rovinnosti je náchylný k napadení nukleofilními druhy, a proto se snadno oxiduje..
Na co se tato oxidace vztahuje? K vytvoření vazby s jakýmkoli jiným atomem, který je více elektronegativní než uhlík; a v případě aldehydů je to kyslík. Aldehyd se tedy oxiduje na karboxylovou kyselinu -COOH. Co když byl aldehyd redukován? Na jeho místě by se vytvořil primární alkohol, ROH.
Aldehydy se vyrábějí pouze z primárních alkoholů: z těch, kde je skupina OH na konci řetězce. Podobně formylová skupina navždy je na konci řetězce nebo z něj nebo z kruhu vyčnívá jako substituent (pokud existují další důležitější skupiny, například -COOH).
Fyzikální a chemické vlastnosti
Jelikož se jedná o polární sloučeniny, jejich teploty tání jsou vyšší než u nepolárních sloučenin. Molekuly aldehydu nejsou schopné intermolekulární vazby prostřednictvím vodíkových vazeb, protože mají pouze atomy uhlíku připojené k atomům vodíku..
Vzhledem k výše uvedenému mají aldehydy nižší teploty varu než alkoholy a karboxylové kyseliny.
Body tání
Formaldehyd -92; Acetaldehyd -121; Propionaldehyd -81; n-butyraldehyd -99; n-Valeraldehyd -91; Kaproaldehyd -; Heptaldehyd - 42; Fenylacetaldehyd -; Benzaldehyd -26.
Body varu
Formaldehyd -21; Acetaldehyd 20; Propionaldehyd 49; n-butyraldehyd 76; n-Valeraldehyd 103; Kaproaldehyd 131; Heptaldehyd 155; Fenylacetaldehyd 194; Benzaldehyd 178.
Rozpustnost ve vodě vyjádřená v g / 100 g HdvaNEBO
Formaldehyd, velmi rozpustný; Acetaldehyd, nekonečný; Propionaldehyd, 16; n-butyraldehyd, 7; n-Valeraldehyd, málo rozpustný; kaproaldehyd, málo rozpustný; Mírně rozpustný fenylacetaldehyd; Benzaldehyd, 0,3.
Body varu aldehydů mají tendenci se zvyšovat přímo s molekulovou hmotností. Naopak existuje tendence snižovat rozpustnost aldehydů ve vodě se zvyšováním jejich molekulové hmotnosti. To se odráží ve fyzikálních konstantách právě zmíněných aldehydů..
Reaktivita
Oxidační reakce
Aldehydy mohou být oxidovány na odpovídající karboxylovou kyselinu v přítomnosti kterékoli z těchto sloučenin: Ag (NH3)dva, KMnO4 dobředvaCrdvaNEBO7.
Redukce na alkoholy
Mohou být hydrogenovány pomocí niklu, platiny nebo palladia jako katalyzátoru. C = O se tedy stává C-OH.
Redukce na uhlovodíky
V přítomnosti Zn (Hg), koncentrované HC1 nebo v NHdvaNHdva aldehydy ztrácejí karbonylovou skupinu a stávají se uhlovodíky.
Nukleofilní přidání
Existuje několik sloučenin, které se přidávají do karbonylové skupiny, mezi nimi jsou: Grignardova činidla, kyanid, deriváty amoniaku a alkoholů.
Nomenklatura
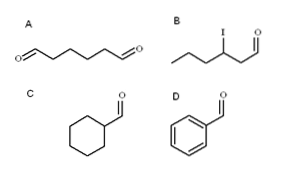
Na obrázku výše jsou znázorněny čtyři aldehydy. Jak se jmenují?
Jelikož se jedná o oxidované primární alkoholy, název alkoholu se změní z -ol na -al. Tedy, methanol (CH3OH), pokud se oxiduje na CH3CHO se nazývá methanal (formaldehyd); CH3CHdvaCHO ethanal (acetaldehyd); CH3CHdvaCHdvaCHO propanal a CH3CHdvaCHdvaCHdvaCHO butanal.
Všechny nově pojmenované aldehydy mají na konci řetězce skupinu -CHO. Když je nalezen na obou koncích, jako v A, je koncovka -al doplněna předponou di-. Vzhledem k tomu, že A má šest uhlíků (počítáme to u obou formylových skupin), je odvozeno od 1-hexanolu a jeho název je proto: hexanvytočit.
Pokud existuje substituent, jako je alkylový radikál, dvojná nebo trojná vazba, nebo halogen, jsou uhlíky hlavního řetězce uvedeny a dávají -CHO číslo 1. Aldehydu B se tedy říká: 3-jodhexanal.
V aldehydech C a D však skupina -CHO nemá prioritu identifikovat takové sloučeniny od ostatních. C je cykloalkan, zatímco D benzen, oba s jedním ze svých Hs substituovaným formylskupinou.
V nich, protože hlavní struktura je cyklická, je formylová skupina pojmenována karbaldehyd. C je tedy cyklohexankarbaldehyd a D je benzenkarbaldehyd (lépe známý jako benzaldehyd).
Aplikace
Aldehydy existují v přírodě schopné propůjčovat příjemné příchutě, jako je tomu v případě cinnamaldehydu, který je odpovědný za charakteristickou chuť skořice. Proto se často používají jako umělá aromata v mnoha výrobcích, jako jsou sladkosti nebo potraviny..
Formaldehyd
Formaldehyd je nejvíce průmyslově vyráběný aldehyd. Formaldehyd získaný oxidací methanolu se použije ve 37% roztoku plynu ve vodě pod názvem formalin. Používá se při vydělávání kůží a při konzervování a balzamování mrtvol..
Podobně se formaldehyd používá jako germicid, fungicid a insekticid pro rostliny a zeleninu. Jeho největším užitkem je však příspěvek k výrobě polymerního materiálu. Plast zvaný bakelit se syntetizuje reakcí mezi formaldehydem a fenolem.
Bakelit
Bakelit je vysoce tvrdý polymer s trojrozměrnou strukturou používaný v mnoha domácích potřebách, jako jsou rukojeti na hrnce, pánve, kávovary, nože atd..
Bakelitové polymery se vyrábějí z formaldehydu v kombinaci se sloučeninami močovina a melamin. Tyto polymery se používají nejen jako plasty, ale také jako lepidla a potahovací materiály..
Překližka
Překližka je obchodní název materiálu tvořeného tenkými dřevěnými deskami spojenými polymery vyrobenými z formaldehydu. Značky Formica a Melmac se vyrábějí za účasti této společnosti. Formica je plastový materiál používaný k obložení nábytku.
Z plastu Melmac se vyrábějí talíře, sklenice, šálky atd. Formaldehyd je surovinou pro syntézu sloučeniny methylen-difenyl-diisokyanát (MDI), prekurzor polyurethanu.
Polyuretan
Polyuretan se používá jako izolátor v chladničkách a mrazničkách, čalounění nábytku, matrací, nátěrů, lepidel, podrážek atd..
Butyraldehyd
Butyraldehyd je hlavním prekurzorem pro syntézu 2-ethylhexanolu, který se používá jako změkčovadlo. Má příjemnou vůni jablek, která umožňuje jeho použití v potravinách jako ochucovadla.
Používá se také k výrobě pryžových urychlovačů. Zasahuje jako meziproduktové činidlo při výrobě rozpouštědel.
Acetaldehyd
Acetaldehyd byl použit při výrobě kyseliny octové. Ale tato role acetaldehydu se zmenšila na důležitosti, protože byla nahrazena karbonylačním procesem methanolu..
Syntéza
Další aldehydy jsou prekurzory oxoalkoholů, které se používají při výrobě detergentů. Tzv. Oxoalkoholy se připravují přidáním oxidu uhelnatého a vodíku k olefinu za získání aldehydu. A nakonec se aldehyd hydrogenuje, aby se získal alkohol.
Některé aldehydy se používají při výrobě parfémů, jako je tomu v případě Chanel č. 5. Mnoho aldehydů přírodního původu má příjemný zápach, například: heptanal má vůni zelené trávy; octanal vůně pomeranče; nonanal vůně růží a citral vůně limetky.
Příklady aldehydů
Glutaraldehyd
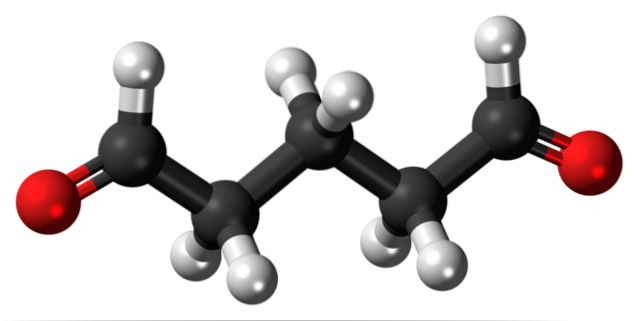
Glutaraldehyd má ve své struktuře na obou koncích dvě formylové skupiny.
Prodáván pod názvem Cidex nebo Glutaral a používá se jako dezinfekční prostředek ke sterilizaci chirurgických nástrojů. Používá se k léčbě bradavic na nohou a nanáší se jako kapalina. Používá se také jako látka fixující tkáň v histologických a patologických laboratořích..
Benzaldehyd
Jedná se o nejjednodušší aromatický aldehyd, který je tvořen benzenovým kruhem, na který je navázána formylová skupina.
Nachází se v mandlovém oleji, a proto je jeho charakteristická vůně, která umožňuje jeho použití jako potravinářské příchuti. Kromě toho se používá při syntéze organických sloučenin souvisejících s výrobou léčiv a při výrobě plastů..
Glyceraldehyd
Je to aldotrióza, cukr složený ze tří atomů uhlíku. Má dva izomery nazývané enantiomery D a L. Glyceraldehyd je první monosacharid získávaný fotosyntézou během temné fáze (Calvinův cyklus)..
Glyceraldehyd-3-fosfát
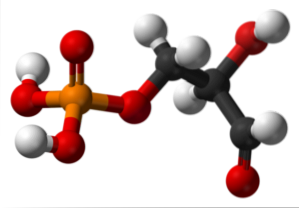
Horní obrázek ilustruje strukturu glyceraldehyd-3-fosfátu. Červené koule vedle žluté odpovídají fosfátové skupině, zatímco černé uhlíkové kostry. Červená koule spojená s bílou je skupina OH, ale když je spojena s černou koulí a druhá s bílou, pak je to skupina CHO.
Glyceraldehyd-3-fosfát se podílí na glykolýze, metabolickém procesu, při kterém se glukóza degraduje na kyselinu pyrohroznovou produkcí ATP, zásobníku energie živých bytostí. Kromě produkce NADH, biologického redukčního činidla.
Při glykolýze pocházejí glyceraldehyd-3-fosfát a dihydroacetonfosfát ze štěpení D-fruktóza-1-6-bisfosfátu
Glyceraldehyd-3-fosfát se podílí na metabolickém procesu známém jako pentózový cyklus. V něm je generován NADPH, důležitý biologický reduktor..
11-cis-retinal
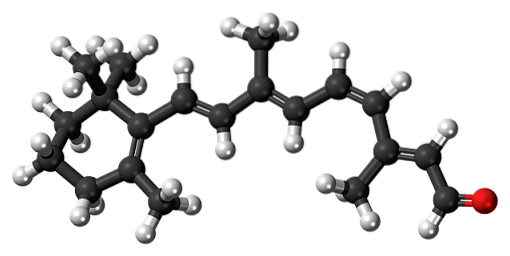
Β-karoten je přírodní pigment přítomný v různých druzích zeleniny, zejména v mrkvi. Podléhá oxidačnímu štěpení v játrech, čímž se transformuje na retinol alkohol nebo vitamin A. Oxidace vitaminu A a následná izomerace jedné z jeho dvojných vazeb tvoří 11-cis-retinální aldehyd.
Pyridoxal fosfát (vitamin B6)
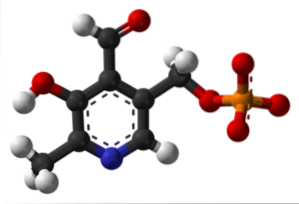
Jedná se o protetickou skupinu spojenou s několika enzymy, která je aktivní formou vitaminu B6 a podílí se na procesu syntézy inhibičního neurotransmiteru GABA.
Kde je formyl skupina ve vaší struktuře? Všimněte si, že se to liší od zbytku skupin spojených s aromatickým kruhem.
Salicylaldehyd
Je to surovina pro syntézu kyseliny acetylsalicylové, analgetického a antipyretického léčiva známého jako Aspirin..
Reference
- Robert C. Neuman, Jr. Kapitola 13, Karbonylové sloučeniny: ketony, aldehydy, karboxylové kyseliny. [PDF]. Převzato z: chem.ucr.edu
- Germán Fernández. (14. září 2009). Názvosloví aldehydů. Převzato z: quimicaorganica.net
- T.W. Graham Solomons, Craigh B. Fryhle. Organická chemie. (Desáté vydání, str. 729–731) Wiley Plus.
- Jerry March a William H. Brown. (31. prosince 2015). Aldehyd. Převzato z: britannica.com
- Wikipedia. (2018). Aldehydy. Převzato z: https://en.wikipedia.org/wiki/Aldehyde
- Morrison, R. T. a Boyd, R. N. (1990). Páté vydání Organic Chemistry. Redakční Addison-Wesley Iberoamericana.
- Carey, F. A. (2006). Organic Chemistry Sixth Edition. Nakladatelství Mc Graw Hill.
- Mathews, Ch. K., Van Holde, K. E. a Athern, K. G. (2002). Biochemie. Třetí edice. Vydavatel Pearson Adisson Wesley.



Zatím žádné komentáře