
Vzorec plynného chloru, účinky, použití a rizika
The plynný chlór (dichlor, diatomický chlor, molekulární chlor nebo jednoduše chlor) je zelenožlutý plyn, s pronikavým a dusivým zápachem, nehořlavý při pokojové teplotě a atmosférickém tlaku.
Je to prvek s nejvyšší afinitou k elektronům a třetí nejvyšší elektronegativitou, jen za kyslíkem a fluorem. Je extrémně reaktivní a silné oxidační činidlo.
Vysoký oxidační potenciál elementárního chloru vedl k vývoji komerčních bělících a dezinfekčních prostředků a také reagencií pro mnoho procesů v chemickém průmyslu..
Ve formě chloridových iontů je chlor nezbytný pro všechny známé druhy života. Ale elementární chlor ve vysokých koncentracích je extrémně nebezpečný a jedovatý pro všechny živé organismy, a proto byl používán v první světové válce jako první plynný chemický bojový prostředek..

Je toxický při vdechování. Dlouhodobé, vdechování nízkých koncentrací nebo krátkodobé, vdechování vysokých koncentrací plynného chloru mají škodlivé účinky na zdraví..
Páry jsou mnohem těžší než vzduch a mají tendenci se usazovat v nízkých oblastech. Nehoří, ale podporuje spalování. Je mírně rozpustný ve vodě. Kontakt s neomezenými kapalinami může způsobit omrzliny způsobené odpařováním.
Používá se k čištění vody, bělení buničiny a výrobě dalších chemikálií.
Rejstřík článků
- 1 vzorec
- 2 2D struktura
- 3 Funkce
- 3.1 Fyzikální a chemické vlastnosti
- 3.2 Upozornění na reaktivitu
- 3.3 Hořlavost
- 3.4 Reaktivita
- 3.5 Toxicita
- 4 použití
- 5 Klinické účinky
- 6 Bezpečnost a rizika
- 6.1 Třídy nebezpečnosti GHS
- 6.2 Kódy bezpečnostních pokynů
- 7 Reference
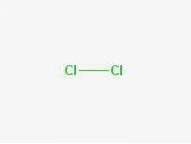
Vzorec
Vzorec: Cl-Cl
Číslo CAS: 7782-50-5
2D struktura

Vlastnosti
Fyzikální a chemické vlastnosti

Plynný chlor patří do reaktivní skupiny silných oxidačních činidel. Tyto sloučeniny často intenzivně reagují s jinými sloučeninami..
Plynný chlór také patří do reaktivní skupiny silných halogenačních činidel, která přenášejí jeden nebo více atomů halogenu na sloučeninu, se kterou reagují..
Halogenační činidla jsou obecně kyselá, a proto reagují, v některých případech prudce, s bázemi.
Mnoho z těchto sloučenin reaguje na vodu a na vzduch. Halogeny jsou vysoce elektronegativní a silné oxidanty.
Upozornění na reaktivitu
Plynný chlor je silné oxidační činidlo. Reaguje s vodou. Voda rozpouští plynný chlór a vytváří směs kyseliny chlorovodíkové a kyselin chlorných.
Hořlavost
Může vznítit jiné hořlavé materiály (dřevo, papír, olej atd.). Míchání s palivem může způsobit výbuch. Při kontaktu s ohněm může obal explodovat. Hromadění par v interiéru, ve stokách nebo venku hrozí nebezpečí výbuchu (a otravy)..
Směsi vodíku a chloru (5–95%) mohou explodovat působením téměř jakékoli formy energie (teplo, sluneční světlo, jiskry atd.).
Při zahřívání vydává vysoce toxické výpary. V kombinaci s vodou nebo párou vytváří toxické a korozivní páry kyseliny chlorovodíkové.
Reaktivita
Chlor reaguje výbušně s (nebo podporuje spalování) mnoha běžných materiálů.
- Chlor zapaluje ocel při 100 ° C v přítomnosti sazí, oxidů, uhlíku nebo jiných katalyzátorů.
- Zapněte suchou ocelovou vlnu při 50 ° C.
- Zapalte sirníky při pokojové teplotě.
- Zapalovače (v tekuté formě) přírodní a syntetický kaučuk.
- Ignites trialkylborany a oxid wolframu.
- Ignity ve styku s hydrazinem, hydroxylaminem a nitridem vápníku.
- Zapálí nebo exploduje s arsinem, fosfinem, silanem, diboranem, stibinem, červeným fosforem, bílým fosforem, bórem, aktivním uhlím, křemíkem, arsenem.
- Při probublávání studeným metanolem způsobuje vznícení a jemnou explozi.
- Při nadměrném smíchání s amoniakem a zahřátí exploduje nebo vznítí.
- Při kontaktu s biuretovým činidlem kontaminovaným kyselinou kyanurovou tvoří výbušný chlorid dusitý.
- S aziridinem snadno tvoří výbušné deriváty N-chloru.
Chlor (v kapalné nebo plynné formě) reaguje s:
- Alkoholy (exploze)
- Roztavený hliník (exploze)
- Silanes (exploze)
- Brom-pentafluorid
- Sirouhlík (exploze katalyzovaná železem)
- Chlor-2-propin (přebytek chloru způsobuje výbuch)
- Dibutyl ftalát (exploze při 118 ° C)
- Diethylether (svítí)
- Diethyl zinek (svítí)
- Glycerol (exploze při 70-80 ° C)
- Metan na žlutém oxidu rtuti (exploze)
- Acetylen (exploze vyvolaná slunečním zářením nebo zahřátím)
- Ethylen na rtuti, oxidu rtuti (I) nebo oxidu stříbrném (I) (výbuch způsobený teplem nebo světlem)
- Benzín (exotermická reakce a poté detonace)
- Směs hydroxidu nafty a sodíku (prudký výbuch)
- Chlorid zinečnatý (exotermická reakce)
- Vosk (výbuch)
- Vodík (exploze iniciovaná světlem)
- Karbid železa
- Uran a zirkon
- Hydridy sodíku, draslíku a mědi
- Cín
- Hliníkový prášek
- Vanadový prášek
- Hliníková fólie
- Pozlátko
- Měděná fólie
- Vápenatý prášek
- Železný drát
- Manganový prášek
- Draslík
- Antimonový prášek
- Vizmut
- Germanium
- Hořčík
- Sodík
- Zinek
Toxicita
Plynný chlór je jedovatý a při vdechování může být smrtelný. Kontakt může způsobit popáleniny kůže a očí, stejně jako bronchitidu nebo chronické plicní stavy..

Aplikace
Dnes se komerčně používá přibližně 15 000 sloučenin chloru. Chlorid sodný je zdaleka nejběžnější sloučeninou chloru a je hlavním zdrojem chloru a kyseliny chlorovodíkové pro obrovský chemický průmysl s chlórem..
Ze všech vyrobeného elementárního chloru se přibližně 63% použije na výrobu organických sloučenin, 18% na výrobu anorganických sloučenin chloru a zbývajících 19% vyrobeného chloru se použije na bělidla a dezinfekční prostředky..

Mezi nejvýznamnější organické sloučeniny z hlediska objemu výroby patří mimo jiné 1,2-dichlorethan a vinylchlorid (meziprodukty při výrobě PVC), methylchlorid, methylenchlorid, chloroform, chlorid vinyliden.
Mezi hlavní anorganické sloučeniny patří HCl, Cl2O, HOCl, NaClO3, AlCl3, SiCl4, SnCl4, PCl3, PCl5, POCl3, AsCl3, SbCl3, SbCl5, BiCl3, S2Cl2, SC12, SOCI2, ClF3, ICl, ICl3, MoCl3, TiCl3 , ZnCl2 a mnoho dalších.
Plynný chlór se používá v průmyslových bělicích provozech, čištění odpadních vod, výrobě tablet pro chloraci bazénů nebo v chemické válce.
Plynný chlor (známý jako bertholit) byl poprvé použit jako zbraň v první světové válce Německem.
Po prvním použití obě strany konfliktu používaly jako chemickou zbraň chlór, ale brzy jej nahradil fosgen a hořčičný plyn, které jsou smrtelnější..
Plynný chlór byl také používán během války v Iráku v provincii Anbar v roce 2007.
Klinické účinky
Plynný chlor je jednou z nejběžnějších expozic dráždivých látek při vdechování na pracovišti a v životním prostředí. Nedávné studie uvádějí, že směs bělidla (bělidlo vyrobené hlavně na základě chlornanu sodného) s jinými čisticími prostředky je nejčastější příčinou (21% případů) jednorázové expozice při vdechování hlášené v toxikologických střediscích. Ze Spojených států.
Hlavní toxické účinky jsou způsobeny spíše lokálním poškozením tkáně než systémovou absorpcí. Předpokládá se, že poškození buněk je výsledkem oxidace funkčních skupin na buněčných složkách; na reakce s vodou v tkáních za vzniku kyseliny chlorné a kyseliny chlorovodíkové; a tvorba volných radikálů kyslíku (ačkoli tato myšlenka je nyní kontroverzní).
U mírné až středně závažné intoxikace jsou: kašel, dušnost, bolest na hrudi, pocit pálení v krku a v retrosternální oblasti, nevolnost nebo zvracení, podráždění očí a nosu, udušení, svalová slabost, závratě, bolesti břicha a bolest hlavy.
U těžké otravy existují: edém horních dýchacích cest, laryngospazmus, těžký plicní edém, pneumonie, přetrvávající hypoxemie, respirační selhání, akutní poškození plic a metabolická acidóza.
Chronická expozice plynnému chlóru je jednou z nejčastějších příčin astmatu z povolání. Může způsobit dušnost, palpitace, bolest na hrudi, syndrom reaktivní dysfunkce horních cest dýchacích, erozi zubní skloviny a zvýšenou prevalenci virových syndromů. Chronická expozice 15 ppm způsobuje kašel, hemoptýzu, bolest na hrudi a bolest v krku.
Dermální expozice může způsobit zarudnutí kůže, bolest, podráždění a popáleniny. Silná expozice může způsobit kardiovaskulární kolaps a zástavu dýchání. Ve vysokých koncentracích může nastat synkopa a téměř okamžitá smrt. Chlor (jako chlornan) je u pokusných zvířat teratogenní.
Bezpečnost a rizika
Standardní věty o nebezpečnosti globálně harmonizovaného systému klasifikace a označování chemických látek (GHS).
Globálně harmonizovaný systém klasifikace a označování chemických látek (GHS) je mezinárodně schválený systém vytvořený Organizací spojených národů, jehož cílem je nahradit různé standardy klasifikace a označování používané v různých zemích pomocí konzistentních kritérií na globální úrovni (Nations United, 2015 ).
Třídy nebezpečnosti (a jejich odpovídající kapitola GHS), standardy klasifikace a označování a doporučení pro plynný chlór jsou následující (Evropská chemická agentura, 2017; OSN, 2015; PubChem, 2017):
Třídy nebezpečnosti GHS
H270: Může způsobit nebo zesílit požár; Oxidační činidlo [Nebezpečí Oxidující plyny - Kategorie 1]
H280: Obsahuje plyn pod tlakem; Při zahřátí může explodovat [Varovné plyny pod tlakem - stlačený plyn, zkapalněný plyn, rozpuštěný plyn]
H315: Způsobuje podráždění pokožky [Varování Žíravost / dráždivost pro kůži - Kategorie 2]
H319: Způsobuje vážné podráždění očí [Varování Vážné poškození očí / podráždění očí - Kategorie 2A]
H330: Smrtelný při vdechování [Nebezpečí Akutní toxicita, vdechování - Kategorie 1, 2]
H331: Toxický při vdechování [Nebezpečí Akutní toxicita, vdechování - Kategorie 3]
H335: Může způsobit podráždění dýchacích cest [Varování Toxicita pro specifické cílové orgány, jednorázová expozice; Podráždění dýchacích cest - kategorie 3]
H400: Vysoce toxický pro vodní organismy [Varování Nebezpečný pro vodní prostředí, akutní nebezpečí - Kategorie 1]
H410: Vysoce toxický pro vodní organismy, s dlouhodobými účinky [Varování Nebezpečný pro vodní prostředí, dlouhodobé nebezpečí - Kategorie 1]
(PubChem, 2017)
Kódy bezpečnostních pokynů
P220, P244, P260, P261, P264, P271, P273, P280, P284, P302 + P352, P304 + P340, P305 + P351 + P338, P310, P311, P312, P320, P321, P332 + P313, P337 + P313, P362, P370 + P376, P391, P403, P403 + P233, P405, P410 + P403 a P501.
Reference
- Benjah-bmm27 (2007). Dichlorine-gas-3D-vdW [obrázek]. Obnoveno z: commons.wikimedia.org.
- Bundesarchiv (1915). Deutsche Soldaten versprühen künstlichen Nebel [obrázek]. Obnoveno z: commons.wikimedia.org.
- ChemIDplus (2017) 3D structure of 7782-50-5 - Chlor [image] Obnoveno z: chem.nlm.nih.gov.
- Národní úřad pro oceán a atmosféru (NOAA). CAMEO Chemicals. (2017). Datový list reaktivní skupiny. Oxidační činidla, silná. Silver Spring, MD. EU; Obnoveno z: cameochemicals.noaa.gov.
- Oelen, W., (2005). Plynný chlor v láhvi [obrázek]. Obnoveno z: commons.wikimedia.org.
- Sargent, J., (1918). Plyny [obrázek]. Obnoveno z: en.wikipedia.org.
- Tomia (2006). Plastic-recyc-03 [obrázek]. Obnoveno z: commons.wikimedia.org.
- Wikipedia (2017). Chlór. Obnoveno z: en.wikipedia.org.



Zatím žádné komentáře