
Vlastnosti, struktura, použití a příklady alkynů
The alkyny Jsou to uhlovodíky nebo organické sloučeniny, které mají ve svých strukturách trojnou vazbu mezi dvěma uhlíky. Tato trojná vazba (≡) je považována za funkční skupinu, protože představuje aktivní místo molekuly, a proto je zodpovědná za jejich reaktivitu.
Alkyny se sice od alkanů nebo alkenů příliš neliší, ale vzhledem k povaze jejich vazeb vykazují větší kyselost a polaritu. Přesný termín k popisu tohoto malého rozdílu je známý jako nenasycení.

Alkany jsou nasycené uhlovodíky, zatímco alkyny jsou z hlediska původní struktury nejvíce nenasycené. Co to znamená? To je alkan H3C-CH3 (ethan) může být dehydrogenován na HdvaC = CHdva (ethen) a později na HC≡CH (ethyn, nebo lépe známý jako acetylen).
Všimněte si, jak se mezi uhlíky vytvářejí další vazby, počet vodíků vázaných k nim klesá. Uhlík se kvůli svým elektronickým vlastnostem snaží vytvořit čtyři jednoduché vazby, takže čím vyšší je nenasycení, tím větší je tendence reagovat (s výjimkou aromatických sloučenin).
Na druhou stranu je trojitá vazba mnohem silnější než dvojná vazba (=) nebo jednoduchá vazba (-), ale za vysoké náklady na energii. Proto většina uhlovodíků (alkany a alkeny) může při zvýšených teplotách vytvářet trojné vazby..
V důsledku jejich vysokých energií, a když se rozbijí, uvolní hodně tepla. Příklad tohoto jevu je vidět, když se acetylen spaluje kyslíkem a intenzivní teplo plamene se používá ke svařování nebo tavení kovů (horní obrázek).
Acetylen je nejjednodušší a nejmenší alkyn ze všech. Další uhlovodíky lze vyjádřit z jeho chemického vzorce nahrazením H za alkylové skupiny (RC≡CR '). Totéž se děje ve světě organické syntézy prostřednictvím velkého počtu reakcí.
Tento alkyn se vyrábí reakcí oxidu vápenatého z vápence a koksu, suroviny, která poskytuje potřebné uhlíky v elektrické peci:
CaO + 3C => CaCdva + CO
CaCdva Je to karbid vápníku, anorganická sloučenina, která nakonec reaguje s vodou za vzniku acetylenu:
CaCdva + 2HdvaO => Ca (OH)dva + HC≡CH
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti alkynů
- 1.1 Polarita
- 1.2 Kyselost
- 2 Reaktivita
- 2.1 Hydrogenace
- 2.2 Přidání halogenovodíku
- 2.3 Hydratace
- 2.4 Přidávání halogenů
- 2.5 Alkylace acetylenu
- 3 Chemická struktura
- 3.1 Vzdálenost spojů a koncových alkynů
- 4 Názvosloví
- 5 použití
- 5.1 Acetylen nebo ethyn
- 5.2 Přírodní alkyny
- 6 Příklady alkynů
- 6.1 Kyselina tarirová
- 6.2 Histrionicotoxin
- 6.3 Cicutoxin
- 6.4 Capillin
- 6.5 Pargyline
- 7 Reference
Fyzikální a chemické vlastnosti alkynů
Polarita
Trojná vazba odlišuje alkyny od alkanů a alkenů. Tyto tři typy uhlovodíků jsou nepolární, nerozpustné ve vodě a velmi slabé kyseliny. Elektronegativita uhlíků s dvojnou a trojnou vazbou je však větší než u uhlíku s jedním uhlíkem..
Uhlíky sousedící s trojnou vazbou tedy indukují indukci hustotu záporného náboje. Z tohoto důvodu tam, kde jsou vazby C≡C nebo C = C, bude vyšší hustota elektronů než ve zbytku uhlíkového skeletu. Důsledkem je malý dipólový moment, kdy molekuly interagují pomocí dipól-dipólových sil..
Tyto interakce jsou velmi slabé, pokud jsou jejich dipólové momenty porovnány s momenty molekuly vody nebo alkoholu. To se odráží v jejich fyzikálních vlastnostech: alkyny mají obecně vyšší teploty tání a teploty varu ve srovnání s jejich méně nenasycenými uhlovodíky..
Podobně jsou díky své nízké polaritě méně nerozpustné ve vodě, ale jsou rozpustné v nepolárních organických rozpouštědlech, jako je benzen..
Kyselost
Tato elektronegativita také způsobuje vodík HC≡CR je kyselější než jakékoli jiné uhlovodíky. Alkyny jsou tedy kyselější druhy než alkeny a mnohem kyselější než alkany. Jeho kyselost je však stále zanedbatelná ve srovnání s kyselostí karboxylových kyselin..
Vzhledem k tomu, že alkiny jsou velmi slabé kyseliny, reagují pouze s velmi silnými zásadami, jako je například amid sodný:
HC≡CR + NaNHdva => HC≡CNa + NH3
Z této reakce se získá roztok acetylidu sodného, suroviny pro syntézu dalších alkynů..
Reaktivita
Reaktivita alkynů je vysvětlena přidáním malých molekul k jejich trojné vazbě, což snižuje jejich nenasycenost. Může se jednat o molekuly vodíku, halogenovodíky, vodu nebo halogeny..
Hydrogenace
Malá molekula Hdva je velmi nepolapitelný a rychlý, aby se zvýšilo riziko, že se přidají k trojné vazbě alkynů, je třeba použít katalyzátory.
Obvykle se jedná o kovy (Pd, Pt, Rh nebo Ni) jemně rozdrcené, aby se zvětšila povrchová plocha; a tedy kontakt mezi vodíkem a alkynem:
RC≡CR '+ 2Hdva => RCHdvaCHdvaR '
Výsledkem je, že vodík je „ukotven“ na uhlících, které rozbíjejí vazbu atd., Dokud nevznikne odpovídající alkan, RCHdvaCHdvaR '. To nejen nasytí počáteční uhlovodík, ale také upraví jeho molekulární strukturu..
Přidání halogenovodíku
Zde se přidá anorganická molekula HX, kde X může být kterýkoli z halogenů (F, Cl, Br nebo I):
RC≡CR '+ HX => RCH = CXR'
Hydratace
Hydratace alkynů je, když přidají molekulu vody za vzniku aldehydu nebo ketonu:
RC≡CR '+ HdvaO => RCHdvaCOR '
Pokud R 'je H, je to aldehyd; pokud je to alkyl, pak je to keton. Při reakci vzniká jako meziprodukt sloučenina známá jako enol (RCH = C (OH) R ')..
Toto podléhá přeměně z enolové formy (C-OH) na ketonovou formu (C = O) v rovnováze zvané tautomerizace.
Přidávání halogenů
A co se týče přídavků, diatomické molekuly halogenů (Xdva= Fdva, Cldva, Brdva slyšel jsemdva):
RC≡CR '+ 2Xdva => RCXdva-CXdvaR '
Alkylace acetylenu
Další alkiny lze připravit z roztoku acetylidu sodného za použití alkylhalogenidu:
HC≡CNa + RX => HC≡CR + NaX
Například pokud by to byl methyljodid, pak by výsledný alkyn byl:
HC≡CNa + CH3I => HC≡CCH3 + NaX
HC≡CCH3 je špička, známá také jako methylacetylén.
Chemická struktura
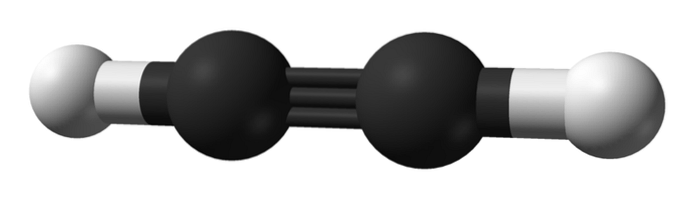
Jaká je struktura alkynů? Molekula acetylenu je zobrazena na horním obrázku. Z ní lze jasně pozorovat lineární geometrii vazby C enlaceC.
Proto tam, kde existuje trojná vazba, by měla být struktura molekuly lineární. To je další z pozoruhodných rozdílů mezi nimi a zbytkem uhlovodíků.
Alkany jsou obvykle reprezentovány cikcaky, protože mají sp hybridizaci3 a jejich odkazy jsou od sebe vzdáleny 109 °. Ve skutečnosti jsou řetězcem kovalentně spojených čtyřstěnů. Zatímco alkeny jsou sp hybridizací sp plochédva jeho uhlíků, konkrétněji tvoří trigonální rovinu s vazbami oddělenými 120 °.
V alkynech je orbitální hybridizace sp, to znamená, že mají 50% s charakter a 50% p charakter. Existují dva hybridní sp orbitaly, které se vážou na atomy H v acetylenu nebo na alkylové skupiny v alkynech..
Vzdálenost mezi dvěma H nebo R je 180 °, navíc k tomu, že pouze tímto způsobem mohou čisté p orbitaly uhlíků vytvořit trojnou vazbu. Z tohoto důvodu je vazba -C≡C- lineární. Při pohledu na strukturu jakékoli molekuly vyniká -C≡C- v těch oblastech, kde je kostra velmi lineární.
Vzdálenost spojů a koncových alkynů
Uhlíky v trojné vazbě jsou blíže k sobě než v dvojné nebo jednoduché vazbě. Jinými slovy, C≡C je kratší než C = C a C-C. V důsledku toho je vazba silnější, protože dvě vazby π pomáhají stabilizovat jednoduchou vazbu σ..
Pokud je trojná vazba na konci řetězce, jedná se o koncový alkyn. Proto musí být vzorec uvedené sloučeniny HC≡CR, kde H zdůrazňuje konec nebo začátek řetězce.
Pokud se naopak jedná o vnitřní trojnou vazbu, má vzorec RC≡CR ', kde R a R' jsou pravá a levá strana řetězce.
Nomenklatura
Jak jsou alkyny pojmenovány podle pravidel daných IUPAC? Stejným způsobem, jako byly pojmenovány alkany a alkeny. Za tímto účelem se přípona -ano nebo -eno změní na příponu -ino.
Například: HC≡CCH3 jmenuje se propin, protože má tři uhlíky, jako je propan (CH3CHdvaCH3). HC≡CCHdvaCH3 je 1-butin, což je koncový alkyn. Ale v případě CH3C≡CCH3 je to 2-butin a v tomto případě není trojná vazba terminální, ale vnitřní.
CH3C≡CCHdvaCHdva(CH3)dva je 5-methyl-2-hexyn. Uhlíky se počítají ze strany nejblíže trojné vazbě.
Dalším typem alkynů jsou cykloalkiny. Pro ně stačí nahradit příponu -ano příslušným cykloalkanem -ino. Tak cyklopropan, který má trojnou vazbu, je pojmenován jako cyklopropino (který neexistuje).
Pokud existují dvě trojné vazby, je k názvu přidána předpona di-. Příklady jsou HC2C-C2H, diacetylen nebo propadino; a na HC2C-C-C2H, butadiino.
Aplikace
Acetylen nebo ethyn
Nejmenší z alkynů zesiluje možný počet použití těchto uhlovodíků. Z toho lze prostřednictvím alkylací syntetizovat další organické sloučeniny. Podobně prochází oxidačními reakcemi za získání ethanolu, kyseliny octové, kyseliny akrylové a dalších..
Další z jeho použití spočívá v poskytnutí zdroje tepla k excitaci elektronů atomů; konkrétněji kovových kationtů při stanovení atomové absorpce a emise, široce používaná spektroskopická technika.
Přírodní alkyny
Jediné existující způsoby přípravy alkynů jsou nejen syntetické nebo s použitím tepla v nepřítomnosti kyslíku, ale také biologické.
Používají enzymy zvané acetylenázy, který může dehydrogenovat dvojnou vazbu. Díky tomu se získává mnoho přírodních zdrojů alkynů.
V důsledku toho mohou být z těchto zdrojů extrahovány jedy, antidota, léky nebo jakákoli jiná sloučenina, která poskytuje určitou výhodu; zvláště pokud jde o zdraví. Existuje mnoho alternativ při úpravách jejich původních struktur a jejich podpoře pro nové alkyny..
Příklady alkynů
Dosud bylo zmíněno mnoho příkladů alkynů. Některé však pocházejí z velmi specifických zdrojů nebo mají konkrétní molekulární struktury: jsou to polyacetyleny.
To znamená, že může existovat více než jedna trojná vazba, která je součástí velmi velké struktury, nejen jednoduchého uhlíkového řetězce..
Kyselina tarirová

Kyselina tarirová pochází z rostliny v Guatemale zvané Picramnia tariri. Speciálně se získává z oleje ze semen.
Ve své molekulární struktuře lze pozorovat jedinou trojnou vazbu, která odděluje apolární ocas od polární hlavy; proto by to mohlo být považováno za amfipatickou molekulu.
Histrionicotoxin
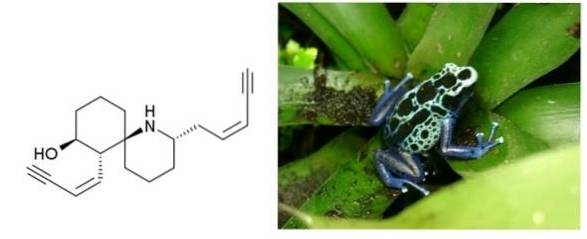
na en.wikipedia [Public domain], z Wikimedia Commons
Histrionicotoxin je jed vylučovaný kůží žab obývající Kolumbii, Brazílii a další latinskoamerické země. Má dvě trojné vazby konjugované s jednou dvojnou vazbou. Oba jsou koncové a oddělené šest uhlíkovým kruhem a cyklickým aminem..
Cicutoxin
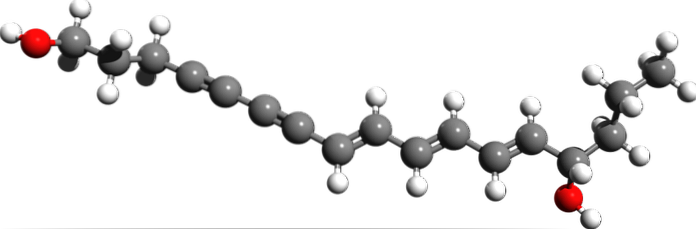
Kde jsou z molekulární struktury cicutoxinu trojné vazby? V případě, že dvojné vazby jsou ploché, jak je vidět na pravé straně, a jednoduché vazby jsou čtyřboká, jak na koncích, trojice jsou lineární a jsou na svahu (\).
Tato sloučenina sestává z neurotoxinu nacházejícího se převážně ve vodní hemlock rostlině..
Capillina
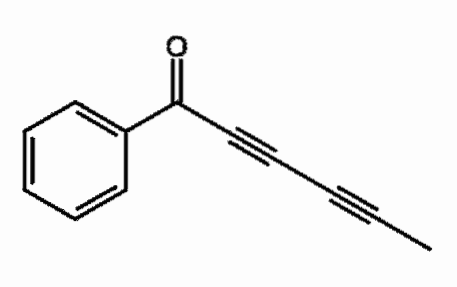
Jedná se o alkyn přítomný v éterickém oleji z rostlin pelyňku, který se používá jako protiplísňový prostředek. Lze pozorovat dvě po sobě jdoucí trojné vazby, přesněji konjugované.
Co to znamená? Tyto trojné vazby rezonují v celém uhlíkovém řetězci a zahrnují otevření dvojné vazby C = O do C-O-.
Pargyline
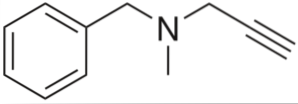
Je to alkyn s antihypertenzním účinkem. Při analýze jeho struktury po částech máme: benzylovou skupinu vlevo, terciární amin uprostřed a propynyl vpravo; tj. koncová propinová skupina.
Reference
- Francis A. Carey. Organická chemie. Karboxylové kyseliny. (šesté vydání, str. 368-397). Mc Graw Hill.
- Brennanová, Johne. (10. března 2018). Příklady alkyny. Vědění. Převzato z: sciencing.com
- BYJU'S. (2018). Triple Bond v Alkynes. Převzato z: byjus.com
- Encyklopedie příkladů (2017). Alkyny. Obnoveno z: examples.co
- Kevin A. Boudreaux. Alkyny. Převzato z: angelo.edu
- Robert C. Neuman, Jr. Alkenes and Alkynes. [PDF]. Převzato z: chem.ucr.edu



Zatím žádné komentáře