
Uhlíkové allotropy amorfní uhlík, grafit, grafeny, nanotrubice

The uhlíkové allotropy jsou to různé fyzické formy, ve kterých mohou být jejich atomy uspořádány a spojeny. Každý odpovídá tělesu se svými zvláštními vlastnostmi. Molekulárně a strukturně se navzájem odlišují. Existují dva hlavní typy těchto alotropů: krystalické a amorfní..
Krystalické allotropy jsou ty, které mají opakující se vzorec atomů ve vesmíru. Mezitím jsou v amorfních alotropech atomy uspořádány neuspořádaně, aniž by v pevné látce byly dvě identické oblasti. Takže první jsou objednané a ty druhé špinavé.
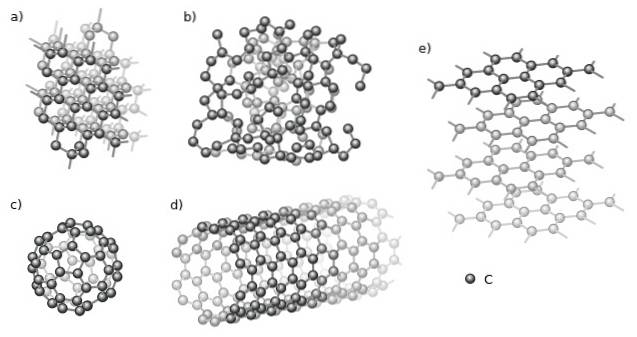
(https://creativecommons.org/licenses/by-sa/4.0)]
Mezi krystalické patří diamant (a) a grafit (e) par excellence. Na horním obrázku je vidět různé struktury, které mají společný aspekt: jsou složeny pouze z atomů uhlíku (černé koule).
A mezi amorfními alotropy máme amorfní uhlík (b), jehož struktura je, jak je vidět, neuspořádaná. Existuje však mnoho druhů amorfních uhlíků, takže jde o rodinu pevných látek..
Atomy uhlíku mohou také tvořit supramolekuly, jako jsou fullereny (c) a nanotrubice (d). Tyto supramolekuly se mohou lišit velikostí a tvarem, ale zachovávají si stejnou geometrii; sférické a tubulární pro fullereny a nanotrubice.
Rejstřík článků
- 1 Kovalentní vazby uhlíku
- 1.1 Šestiúhelníky
- 1,2 čtyřstěn
- 2 Amorfní uhlík
- 2.1 Politismus
- 2.2 Funkční skupiny
- 3 Grafit
- 3.1 Fyzikální vlastnosti
- 4 grafeny
- 5 uhlíkových nanotrubiček
- 5.1 Strukturální konformace
- 6 fullerenů
- 7 Reference
Kovalentní vazby uhlíku
Předtím, než se budeme zabývat některými ze známých alotropů uhlíku, je nutné přezkoumat, jak se atomy uhlíku váží..
Podle teorie valenčních vazeb má uhlík ve své valenční skořápce čtyři elektrony, s nimiž tvoří kovalentní vazby. Díky elektronické propagaci a hybridizaci lze čtyři elektrony umístit na čtyři samostatné orbitaly, ať už čisté nebo hybridní.
Uhlík má tedy schopnost tvořit až maximálně čtyři vazby.
DC. Tím, že mají čtyři vazby C-C, atomy dosáhnou valenčního oktetu a stanou se velmi stabilními. To však neznamená, že nemohou existovat pouze tři z těchto odkazů, například ty, které jsou vidět v šestiúhelnících..
Šestiúhelníky
V závislosti na hybridizaci atomu uhlíku lze ve struktuře jejich příslušných alotropů nalézt dvojné nebo trojné vazby. Ale ještě evidentnější než existence takových vazeb je geometrie, kterou uhlíky přijímají.
Pokud je například pozorován šestiúhelník, znamená to, že uhlíky mají sp hybridizacidva a proto mají orbitál p čistý s osamělým elektronem. Vidíte na prvním obrázku dokonalé šestiúhelníky? Tyto alotropy, které je obsahují, znamenají, že jejich uhlíky jsou spdva, bez ohledu na to, zda existují dvojné vazby (například vazby benzenového kruhu).
Síť, rovina nebo šestihranná vrstva se potom skládají z uhlíků spdva který má elektronický „strop“ nebo „mrak“, produkt nepárového elektronu orbitálu p. Tento elektron může vytvářet kovalentní vazby s jinými molekulami nebo přitahovat kladné náboje kovových iontů; jako K.+ a Na+.
Podobně tyto elektrony umožňují, aby se tyto skořápky stohovaly na sebe, bez lepení (kvůli geometrické a prostorové překážce překrytí dvou orbitalů p). To znamená, že allotropům s hexagonální geometrií může nebo nemusí být nařízeno, aby postavili krystal..
Čtyřstěn
Pokud je pozorován čtyřstěn, jak bude vysvětleno v poslední části, znamená to, že uhlíky mají sp hybridizaci3. V nich jsou čtyři jednoduché vazby C-C a tvoří čtyřbokou krystalovou mřížku. V takových čtyřstěnách nejsou žádné volné elektrony jako v šestiúhelnících..
Amorfní uhlík

Amorfní uhlík lze představit jako druh porézní houby se spoustou libovolně uspořádaných hexagonálních a čtyřbokých sítí. V této minerální matrici mohou zachycovat další prvky, které mohou uvedenou houbu zhutnit nebo roztáhnout; a stejným způsobem mohou být jeho strukturní jádra větší nebo menší.
V závislosti na% uhlíku jsou tedy odvozeny různé typy amorfních uhlíků; jako jsou saze, dřevěné uhlí, antracit, saze, rašelina, koks a aktivní uhlí.
Na první pohled vypadají všichni vzdáleně podobně (horní obrázek), s přechody k okraji černé, matné nebo metalické a šedavé podtóny..
Ne všechny amorfní uhlíky mají stejný původ. Rostlinný uhlík, jak naznačuje jeho název, je produktem spalování rostlinných hmot a dřeva. Zatímco saze a koks jsou produkty různých stadií a podmínek ropných procesů..
I když se nezdají příliš atraktivní a lze předpokládat, že slouží pouze jako palivo, pórovitost jejich pevných látek přitahuje pozornost v technologických aplikacích čištění, jako jsou absorpční prostředky a skladování látek, a také jako katalytické nosiče..
Politypism
Struktury amorfních uhlíků jsou složité a neuspořádané; ale krystalografické studie ukázaly, že ve skutečnosti se jedná o čtyřstěnné (diamantové) a šestihranné (grafitové) polytypy, uspořádané libovolně ve vrstvách.
Například pokud T a H jsou čtyřboká, respektive šestihranná vrstva, pak lze amorfní uhlík strukturně popsat jako: THTHHTH; nebo HTHTTHTHHHT atd. Určité sekvence vrstev T a H definují typ amorfního uhlíku; ale v nich není žádný opakující se trend nebo vzor.
Z tohoto důvodu je strukturálně obtížné tyto uhlíkové alotropy charakterizovat; a místo toho je upřednostňováno jeho% uhlíku, což je proměnná, která usnadňuje jeho rozdíly, kromě jeho fyzikálních vlastností a jeho tendence hořet nebo hořet.
Funkční skupiny
Bylo zmíněno, že hexagonální roviny mají nepárový elektron, s nímž může vytvářet vazbu s jinými molekulami nebo atomy. Pokud jsou okolní molekuly HdvaO a COdva, Lze očekávat, že se vytvoří skupiny OH a COOH. Mohou se také vázat na atomy vodíku a vytvářet vazby CH..
Možnosti jsou velmi rozmanité, ale souhrnně mohou amorfní uhlíky hostovat okysličené funkční skupiny. Jsou-li tyto heteroatomy přítomny, nacházejí se nejen na okrajích rovin, ale také a dokonce i uvnitř.
Grafit

Obrázek výše ukazuje model s koulemi a řetězci krystalické struktury grafitu. Naštěstí stíny koulí pomáhají vizualizovat mraky n v důsledku delokalizace jejich nepárových elektronů. To bylo zmíněno v první části, bez tolika podrobností.
Tyto π mraky lze přirovnat ke dvěma systémům: systému benzenových kruhů a systému „elektronových moří“ v kovových krystalech..
Orbitály p spojují se navzájem a vytvářejí dráhu, kde elektrony volně cestují; ale pouze mezi dvěma šestiúhelníkovými vrstvami; kolmo k nim není tok elektronů ani proudu (elektrony by musely procházet atomy uhlíku).
Protože dochází k neustálé migraci elektronů, neustále se vytvářejí okamžité dipóly, které indukují další dipóly atomů uhlíku, které jsou nad nebo pod; to znamená, že vrstvy nebo listy grafitu zůstávají pohromadě díky londýnským rozptylovým silám..
Tyto šestihranné vrstvy, jak lze očekávat, vytvářejí krystal hexagonálního grafitu; nebo spíše řada malých krystalů spojených v různých úhlech. Mraky π se chovají, jako by šlo o „elektrické máslo“, což umožňuje klouzání vrstev před vnějším rušením na krystalech.
Fyzikální vlastnosti
Fyzikální vlastnosti grafitu lze snadno pochopit, jakmile bude řešena jeho molekulární struktura..
Například teplota tání grafitu je velmi vysoká (nad 4400 ° C), protože energie dodávaná ve formě tepla musí nevratně oddělit šestihranné vrstvy a také rozbít jejich šestiúhelníky..
Právě bylo řečeno, že jejich vrstvy mohou klouzat přes sebe; A nejen, ale mohou také skončit na povrchu jiných povrchů, jako je celulóza, která tvoří papír, když je nanesen z grafitu tužek. Tato vlastnost umožňuje grafitu působit jako vynikající mazivo..
A jak již bylo zmíněno, je to dobrý vodič elektřiny a také tepla a zvuku..
Graphenes

Ačkoli to nebylo ukázáno na prvním obrázku, nelze tento uhlíkový allotrope vynechat. Předpokládejme, že vrstvy grafitu byly uchopeny a kondenzovány do jednoho listu, otevřeného a pokrývajícího velkou plochu. Pokud by to bylo provedeno molekulárně, zrodily by se grafeny (horní obrázek).
Grafeny jsou tedy individuální grafitový list, který neinteraguje s ostatními a může mávat jako vlajka. Všimněte si, že to připomíná stěny pláství včel.
Tyto grafenové listy zachovávají a znásobují vlastnosti grafitu. Jeho šestihrany se velmi těžko oddělují, a proto mají propastnou mechanickou odolnost; dokonce vyšší než ocel. Kromě toho jsou extrémně lehké a tenké a teoreticky by jeden gram z nich stačil na pokrytí celého fotbalového hřiště..
Když se znovu podíváte na horní obrázek, uvidíte, že neexistují žádné dvojné vazby. Určitě tam mohou být, stejně jako trojné vazby (graffiny). Tady se říká chemie grafenu.
Stejně jako grafit a další šestihranné vrstvy se i jiné molekuly mohou kovalentně vázat na povrch grafenu a funkcionalizovat jeho strukturu pro elektronické a biologické aplikace..
Uhlíkové nanotrubice
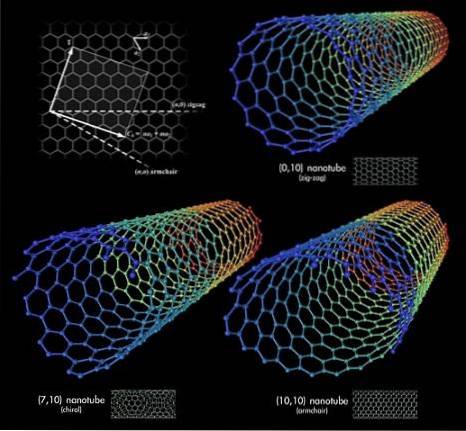
Nyní předpokládejme, že jsme popadli grafenové listy a začali je válcovat do tuby; To jsou uhlíkové nanotrubice. Délky a poloměry těchto trubek jsou proměnlivé, stejně jako jejich prostorové konformace. Spolu s grafenem a fullereny tvoří tyto nanotrubice trojici nejpřekvapivějších uhlíkových allotropů.
Strukturální konformace
Na horním obrázku jsou zobrazeny tři uhlíkové nanotrubice. Jaký je mezi nimi rozdíl? Všechny tři mají šestihranné vzorované stěny a vykazují stejné povrchové vlastnosti, jak již bylo uvedeno. Odpověď pak spočívá v relativní orientaci těchto šestiúhelníků.
První konformace odpovídá typu cikcak (pravý horní roh). Pokud se podíváte pozorně, uvidíte, že má řady šestiúhelníků umístěných dokonale kolmo k podélné ose trubky..
Naproti tomu pro typovou konformaci křeslo, nebo židle (pravý dolní roh), jsou šestiúhelníky uspořádány v řadách ve stejném směru jako podélná osa trubky. V první nanotrubici běží šestiúhelníky po povrchu ve smyslu svého průměru a ve druhé nanotrubici probíhají po povrchu od „konce do konce“.
A konečně je tu chirální nanotrubice (levý dolní roh). Porovnejte točité schodiště vlevo nebo vpravo. Totéž se děje s touto uhlíkovou nanotrubicí: její šestiúhelníky jsou uspořádány vzestupně doleva nebo doprava. Jelikož existují dvě prostorové verze, říká se, že vykazuje chirality.
Fullereny
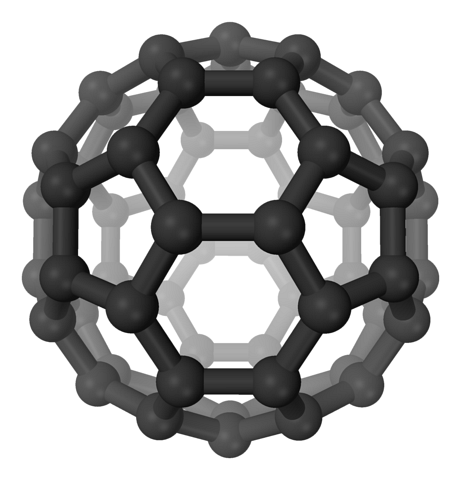
Ve fullerenech jsou šestiúhelníky stále udržovány, ale navíc se objevují pětiúhelníky, všechny se sp uhlíkydva. Listy nebo vrstvy již zůstaly pozadu: nyní byly složeny tak, že tvoří míč, podobný fotbalovému míči; a v závislosti na počtu uhlíků na rugbyovou kouli.
Fullereny jsou molekuly, které se liší velikostí. Nejznámější je C.60 (horní obrázek). S těmito uhlíkovými allotropy by se mělo zacházet jako s balónky, které se mohou stlačit a vytvořit krystaly, ve kterých mohou být uvnitř jejich mezer zachyceny ionty a další molekuly..
Tyto kuličky jsou speciálními nosiči nebo podpěrami pro molekuly. Jak? Skrz kovalentní vazby na jeho povrch, zejména na sousední uhlíky šestiúhelníku. Fulleren se pak říká, že byl funkcionalizován (exohedrální adukt).
Jeho stěny lze strategicky rozbít, aby se uvnitř uložily molekuly; připomínající kulovitou kapsli. Tyto kuličky také mohou mít praskliny a mohou být funkcionalizovány současně; vše bude záviset na aplikaci, pro kterou jsou určeny.
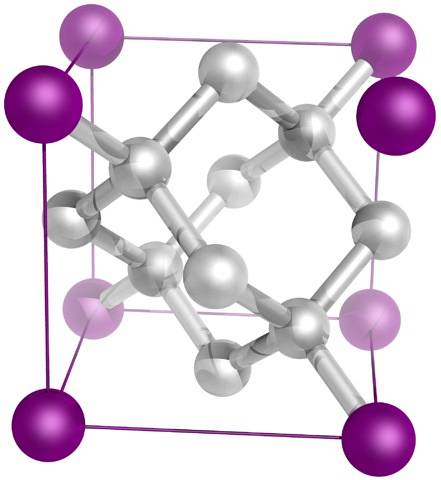
A konečně nejznámější ze všech allotropů uhlíku: diamant (i když ne všechny jsou uhlíkem).
Strukturálně se skládá z atomů uhlíku sp3, tvořící čtyři C-C vazby a trojrozměrnou síť čtyřstěnů (horní obrázek), jejichž krystalická buňka je krychlová. Je to nejtvrdší minerál a jeho teplota tání se blíží 4000 ° C..
Jeho čtyřstěny jsou schopny účinně přenášet teplo skrz krystalovou mřížku; ale ne u elektřiny, protože jeho elektrony jsou velmi dobře umístěny ve čtyřech kovalentních vazbách a nemůže nikam jít. Proto je to dobrý tepelný vodič, ale je to elektrický izolátor..
V závislosti na tom, jak se tváří, může rozptylovat světlo v mnoha jasných a atraktivních úhlech, a proto jsou vyhledávány jako drahokamy a šperky..
Síť je velmi odolná, protože k pohybu čtyřstěnů by potřebovala velký tlak. Tato vlastnost z něj dělá materiál s vysokou mechanickou odolností a tvrdostí, který je schopen provádět přesné a čisté řezy, jako u skalpelu s diamantovým hrotem..
Jejich barvy závisí na jejich krystalografických vadách a jejich nečistotách.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Méndez Medrano, Ma. Guadalupe, Rosu, H. C., Torres González, L. A. (2012). Grafen: nejslibnější allotrope uhlíku. Zákon o vysokých školách. sv. 22, č. 3, duben-květen 2012, str. 20-23, University of Guanajuato, Guanajuato, Mexiko.
- IES La Magdalena. Aviles. Asturie. (s.f.). Allotropní formy uhlíku. [PDF]. Obnoveno z: fisquiweb.es
- Wikipedia. (2019). Uhlíkové allotropy. Obnoveno z: es.wikipedia.org
- Sederberg David. (s.f.). Allotropy uhlíku. Obnoveno z: web.ics.purdue.edu
- Sederberg, D. (2009). Allotropy uhlíku: Všechno je ve způsobu, jakým jste se dali dohromady. Obnoveno z: physics.purdue.edu
- Hirsh A. (2010). Období uhlíkových allotropů. Katedra chemie a farmacie a Interdisciplinární centrum molekulárních materiálů (ICMM), Friedrich-Alexander University Erlangen-Nuremberg, Henkestrasse 42, 91054 Erlangen, Německo.
- Správní rada systému University of Wisconsin. (2013). Nanotrubice a jiné formy uhlíku. Obnoveno z: chemistry.beloit.edu
- Clark Jim. (2012). Obří kovalentní struktury. Obnoveno z: chemguide.co.uk

Zatím žádné komentáře