
Struktura anisolu, vlastnosti, nomenklatura, rizika a použití
The anisol nebo methoxybenzen je organická sloučenina sestávající z aromatického etheru, jehož chemický vzorec je C6H5OCH3. Jeho fyzikální stav je bezbarvá kapalina, která může vykazovat nažloutlé zabarvení. Je snadno rozpoznatelný podle charakteristického anýzového zápachu.
Je to pak těkavá sloučenina a ne příliš vysoké kohezní síly; typické vlastnosti etherů světla, které jsou skladovány v malých uzavřených nádobách. Specificky je anisol nejjednodušší z alkylaryletherů; to znamená ty, které mají aromatickou složku (Ar) a další alkylovou složku (R), Ar-O-R.
Skupina C6H5- přijde k označení Ar a -CH3 až R, tedy C6H5-O-CH3. Aromatický kruh a přítomnost -OCH3 Jako skupina substituentů zvaná methoxy dává anisolu nukleofilitu vyšší než u benzenu a nitrobenzenu. Proto slouží jako mezilehlá molekula pro syntézu sloučenin s farmakologickou aktivitou..
Jeho charakteristická anýzová vůně byla použita k přidání anizolu do kosmetických a hygienických výrobků, které vyžadují příjemnou vůni..
Rejstřík článků
- 1 Struktura anisolu
- 1.1 Dipólový moment
- 1.2 Krystaly
- 2 Vlastnosti
- 2.1 Fyzický vzhled
- 2.2 Zápach
- 2.3 Příchuť
- 2.4 Molekulová hmotnost
- 2.5 Hustota
- 2.6 Hustota par
- 2.7 Teplota tání
- 2.8 Bod varu
- 2.9 Bod vzplanutí
- 2.10 Teplota samovznícení
- 2.11 Viskozita
- 2.12 Povrchové napětí
- 2.13 Index lomu
- 2.14 Rozpustnost
- 2,15 nukleofilita
- 2.16 Reaktivita
- 3 Názvosloví
- 4 Rizika
- 5 použití
- 5.1 Organické syntézy
- 5.2 Vůně
- 6 Reference
Struktura anisolu
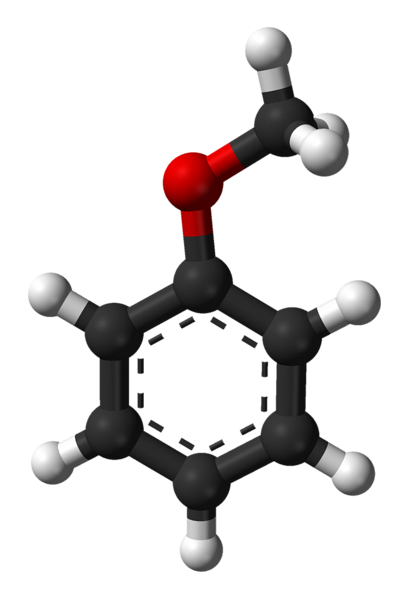
Horní obrázek ukazuje molekulární strukturu anisolu pomocí modelu koulí a tyčí. Oceňuje se aromatický kruh, jehož uhlíky jsou spdva a proto je plochá jako šestihranný plech; a k ní je připojena methoxyskupina, jejíž uhlík je sp3, a jeho vodíky jsou nad nebo pod rovinou kruhu.
Důležitost skupiny -OCH3 ve struktuře jde nad rámec rozbití s rovinnou geometrií molekuly: propůjčuje jí polaritu a následně získá nepolární molekula benzenu trvalý dipólový moment.
Dipólový moment
Tento dipólový moment je způsoben atomem kyslíku, který přitahuje elektronové hustoty jak aromatického, tak methylového kruhu. Díky tomu mohou molekuly anizolu interagovat prostřednictvím dipól-dipólových sil; I když postrádá jakoukoli možnost tvorby vodíkových vazeb, protože se jedná o ether (ROR nemá H vázané na kyslík).
Jeho vysoký bod varu (154 ° C) experimentálně potvrzuje silné mezimolekulární interakce, které řídí jeho kapalinu. Podobně jsou přítomny Londonovy disperzní síly v závislosti na molekulové hmotnosti a interakce π-π mezi samotnými kruhy.
Krystaly
Struktura anisolu mu však neumožňuje dostatečně silně interagovat, aby přijala pevnou látku při teplotě místnosti (t.t. = -37 ° C). To může být také způsobeno skutečností, že když se mezimolekulární vzdálenosti zmenší, elektrostatické odpudy mezi elektrony sousedních aromatických kruhů začnou získávat velkou sílu..
Proto a podle krystalografických studií nemohou být molekuly anizolu v krystalech při teplotě -173 ° C uspořádány tak, aby jejich kruhy směřovaly k sobě; to znamená, že jejich aromatická centra nejsou srovnána jeden na druhém, ale spíše skupina -OCH3 je nad nebo pod sousedním kruhem.
Vlastnosti
Fyzický vzhled
Bezbarvá kapalina, která však může mít slabé slámově zbarvené tóny.
Zápach
Vůně mírně připomíná anýzová semínka.
Chuť
Bonbón; je však mírně toxický, takže tento test je nebezpečný.
Molekulová hmotnost
108,140 g / mol.
Hustota
0,995 g / ml.
Hustota par
3,72 (ve vztahu ke vzduchu = 1).
Bod tání
-37 ° C.
Bod varu
154 ° C.
bod vznícení
125 ° C (otevřený kelímek).
teplota samovznícení
475 ° C.
Viskozita
0,778 cP při 30 ° C.
Povrchové napětí
34,15 dyn / cm při 30 ° C.
Refrakční indikátor
1,5179 při 20 ° C.
Rozpustnost
Špatně rozpustný ve vodě (přibližně 1 mg / ml). V jiných rozpouštědlech, jako je aceton, ethery a alkoholy, je však velmi rozpustný.
Nukleofilita
Aromatický kruh anisolu je bohatý na elektrony. Je to proto, že kyslík, přestože je vysoce elektronegativním atomem, přispívá elektrony ze svého π mraku k jejich delokalizaci přes kruh v mnoha rezonančních strukturách. V důsledku toho prochází aromatickým systémem více elektronů, a proto se zvyšuje jeho nukleofilita..
Zvýšení nukleofilnosti bylo experimentálně prokázáno porovnáním jeho reaktivity s aromatickými elektrofilními substitucemi s reaktivitou benzenu. Je tedy doložen pozoruhodný účinek skupiny -OCH.3 o chemických vlastnostech sloučeniny.
Podobně je třeba poznamenat, že elektrofilní substituce se vyskytují v polohách sousedících (-orto) a opačných (-para) k methoxyskupině; to znamená, že je to ortho-para ředitel.
Reaktivita
Nukleofilita aromatického kruhu anisolu již umožňuje letmý pohled na jeho reaktivitu. Substituce mohou nastat buď v kruhu (zvýhodněný jeho nukleofilitou), nebo v samotné methoxy skupině; v druhém případě je vazba O-CH přerušena3 nahradit -CH3 jinou alkylovou skupinou: O-alkylací.
Proto v procesu alkylace může anisol přijmout skupinu R (fragment jiné molekuly) substitucí H na svém kruhu (C-alkylace) nebo substitucí CH3 jeho methoxyskupiny. Následující obrázek ilustruje, co bylo právě řečeno:
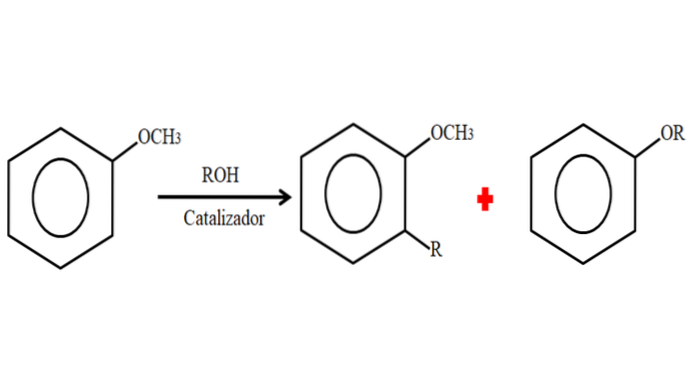
Na obrázku je skupina R umístěna v poloze -orto, ale může být také v poloze -para, naproti -OCH3. Když dojde k O-alkylaci, získá se nový ether s jinou skupinou -OR.
Nomenklatura
Jméno „anisole“ je nejznámější a nejuznávanější, s největší pravděpodobností odvozeno od vůně podobné anýzu. Název „methoxybenzen“ je však zcela specifický, protože okamžitě určuje, jaká je struktura a identita tohoto aromatického etheru; toto je název, který se řídí systematickou nomenklaturou.
Další méně používaný, ale stejně platný název je „fenylmethylether“, který se řídí tradiční nomenklaturou. Toto je možná nejkonkrétnější jméno ze všech, protože přímo naznačuje, které jsou dvě strukturní části etheru: fenyl-O-methyl, C6H5-O-CH3.
Rizika
Lékařské studie dosud nebyly schopny prokázat možné smrtelné účinky anisolu v těle při nízkých dávkách. Jako téměř všechny chemikálie však způsobuje podráždění, pokud je příliš dlouho a v mírných koncentracích vystaveno pokožce, krku, plicím a očím..
Vzhledem k nukleofilitě jeho kruhu je také jeho část metabolizována, a proto je biologicky odbouratelná. Ve skutečnosti v důsledku této vlastnosti simulace ukázaly, že se nemůže koncentrovat ve vodních ekosystémech, protože její organismy ji nejprve degradují; a proto řeky, jezera nebo moře mohou hromadit anisole.
V půdách se díky své těkavosti rychle odpařuje a je unášen vzdušnými proudy; protože tomu tak není, ani to významně neovlivňuje rostlinné masy nebo plantáže.
Na druhou stranu atmosféricky reaguje s volnými radikály, a proto nepředstavuje riziko kontaminace vzduchu, který dýcháme..
Aplikace
Organické syntézy
Z anisolu lze získat jiné deriváty aromatickou elektrofilní substitucí. To umožňuje jeho použití jako meziproduktu pro syntézu léčiv, pesticidů a rozpouštědel, ke kterému je žádoucí přidat jeho vlastnosti. Syntetické cesty mohou sestávat většinou z C-alkylace nebo O-alkylace.
Vůně
Kromě svého použití pro organickou syntézu jej lze použít přímo jako přísadu do krémů, mastí a parfémů, do kterých těchto anýz začleňuje vůně anýzu..
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. A. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10. vydání.). Wiley plus.
- Národní centrum pro biotechnologické informace. (2019). Anisole. Databáze PubChem, CID = 7519. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Anisole. Obnoveno z: en.wikipedia.org
- Pereira, Cynthia C. M., de la Cruz, Marcus H. C., & Lachter, Elizabeth R. (2010). Alkylace anisolu a fenolu v kapalné fázi katalyzovaná fosforečnanem niobičným. Journal of the Brazilian Chemical Society, 21 (2), 367-370. dx.doi.org/10.1590/S0103-50532010000200025
- Seidel R. W. a Goddard R. (2015). Anisol při 100 K: první stanovení krystalové struktury. Acta Crystallogr C Struct Chem. Aug; 71 (Pt 8): 664-6. doi: 10,1107 / S2053229615012553
- Chemická formulace. (2018). Methoxybenzen Obnoveno z: formulacionquimica.com
Zatím žádné komentáře