
Historie, struktura, vlastnosti, použití arsenu
The arsen Jedná se o polokov nebo metaloid, který patří do skupiny 15 nebo VA periodické tabulky. Je reprezentován chemickým symbolem As a jeho atomové číslo je 33. Nalezneme ho ve třech alotropních formách: žlutá, černá a šedá; druhý je jediný s průmyslovým významem.
Šedý arzen je křehká, kovově vypadající pevná látka s ocelovou krystalickou barvou (obrázek níže). Při vystavení vzduchu ztrácí svůj lesk a vytváří oxid arsenitý (AsdvaNEBO3), který při zahřátí vydává česnekový zápach. Na druhé straně jsou jeho žluté a černé allotropy molekulární, respektive amorfní..

Arsen se nachází v zemské kůře spojené s mnoha minerály. Pouze malý podíl se nachází v původním stavu, avšak spojený s antimonem a stříbrem.
Mezi nejběžnější minerály, ve kterých se arsen nachází, patří: realgar (As4S4), orpiment (AsdvaS3), loellingite (FeAsdva) a enargit (Cu3Osel4). Arsen se také získává jako vedlejší produkt při tavení kovů, jako je olovo, měď, kobalt a zlato..
Sloučeniny arsenu jsou toxické, zejména arsin (AsH3). Arsen má však řadu průmyslových aplikací, včetně legování olovem, které se používá při výrobě autobaterií, a legování galliem s různým využitím v elektronice..
Rejstřík článků
- 1 Historie jeho objevu
- 2 Struktura arsenu
- 2.1 Žlutý arsen
- 2.2 Černý arsen
- 3 Elektronická konfigurace
- 4 Vlastnosti
- 4.1 Molekulová hmotnost
- 4.2 Fyzický popis
- 4.3 Barva
- 4.4 Zápach
- 4.5 Příchuť
- 4.6 Teplota tání
- 4.7 Hustota
- 4.8 Rozpustnost ve vodě
- 4.9 Atomový poloměr
- 4.10 Atomový objem
- 4.11 Kovalentní poloměr
- 4.12 Specifické teplo
- 4.13 Odpařovací teplo
- 4.14 Elektronegativita
- 4.15 Ionizační energie
- 4.16 oxidační stavy
- 4.17 Stabilita
- 4.18 Rozklad
- 4.19 Automatické zapalování
- 4.20 Tvrdost
- 4.21 Reaktivita
- 5 použití
- 5.1 Slitiny
- 5.2 Elektronika
- 5.3 Zemědělství a ochrana dřeva
- 5.4 Léčivé
- 5.5 Jiná použití
- 6 Kde je?
- 7 Jak se dostanete?
- 8 Reference
Historie jeho objevu
Název „arsen“ pochází z latinského arzeniku a řeckého arsenikonu, což odkazuje na žlutý oriment, což byla hlavní forma použití arsenu alchymisty.
Arzen, dlouho předtím, než byl uznán jako chemický prvek, byl znám a používal se ve formě svých sloučenin. Například Aristoteles ve 4. století před naším letopočtem. psal o sandarache, látce, o které se nyní předpokládá, že je sulfid arsenitý.
Plinius starší a Pedanius Discórides v 1. století našeho letopočtu popsali orpiment, minerál vyrobený z AsdvaS3. V 11. století byly rozpoznány tři druhy arsenu: bílý (As4NEBO4), žlutá (AsdvaS3) a červená (As4S4).
Arsen jako čistý prvek poprvé pozoroval Albertus Magnus (1250). Magnus zahřál sulfid arzenitý mýdlem, přičemž si všiml vzhledu látky s charakteristikou podobnou šedivému alotropu na obrázku. První autentickou zprávu o jeho izolaci však vydal v roce 1649 německý lékárník Johann Schroeder..
Schroeder připravil arsen zahříváním jeho oxidu dřevěným uhlím. Nicolas Lémery ho následně dokázal vyrobit zahřátím směsi oxidu arsenitého, mýdla a potaše. V 18. století byl tento prvek konečně uznán jako polokov.
Struktura arsenu
Arsen je izomorfní s antimonem; to znamená, že jsou strukturně identické, liší se pouze velikostí svých atomů. Každý atom arsenu tvoří tři kovalentní vazby As-As takovým způsobem, že vznikají hexagonální jednotky As6 „Vrásčitá nebo strmá“, protože hybridizace atomů As je sp3.
Pak jednotky As6 spojují se a vytvářejí čisté vrstvy arsenu, které navzájem slabě interagují. Kvůli svým mezimolekulárním silám, závislým především na jejich atomových hmotnostech, dávají kosodélníkové šedé krystaly arsenu pevné látce křehkou a křehkou strukturu..
Možná kvůli odpuzování volného elektronového páru arsenu, As6 vytvořené mezi paralelními vrstvami nedefinují dokonalý, ale zkreslený osmistěn:
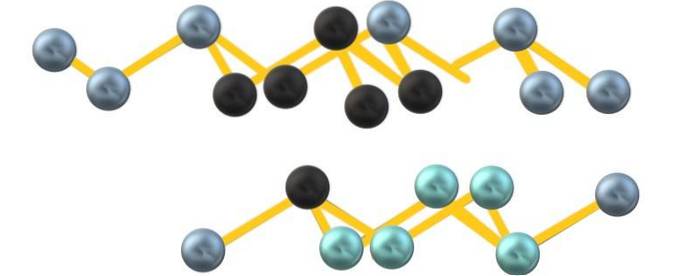
Všimněte si, že černé koule kreslí zkreslenou rovinu v prostoru mezi dvěma strmými vrstvami. Podobně ve spodní vrstvě jsou namodralé koule, které společně s černou koulí tvoří jednotku As6 zmíněno na začátku sekce.
Struktura vypadá spořádaně, řady jdou nahoru a dolů, a proto je krystalická. Může se však stát amorfní a koule mohou být stlačeny různými způsoby. Když se šedivý arzen stane amorfním, transformuje se na polovodič.
Žlutý arsen
Žlutý arzen, nejtoxičtější alotrop tohoto prvku, je čistě molekulární pevná látka. Skládá se z molekul As4 jednotky slabými rozptylovými silami, které jim nebrání v odpařování.
Černý arsen
Černý arzen je amorfní; ale ne to, jak může být šedivý allotrope. Jeho struktura je mírně podobná té, která byla právě popsána, s tím rozdílem, že její roviny jednotek As6 mají větší plochy a různé vzory nepořádku.
Elektronická konfigurace
[Ar] 3d104 sdva4p3
Má naplněné všechny orbitaly úrovně 3. Vytváří vazby pomocí orbitalů 4s a 4p (stejně jako 4d) prostřednictvím různých chemických hybridizací.
Vlastnosti
Molekulární váha
74,922 g / mol
Fyzický popis
Šedý arzen je šedavě pevná látka s kovovým vzhledem a křehkou konzistencí..
Barva
Tři alotropní formy, žlutá (alfa), černá (beta) a šedá (gama).
Zápach
Toaleta
Chuť
Bez chuti
Bod tání
1090 K při 35,8 atm (trojitý bod arsenu).
Za normálního tlaku nemá teplotu tání, protože sublimuje na 887 K..
Hustota
-Šedý arsen: 5,73 g / cm3.
-Žlutý arsen: 1,97 g / cm3.
Rozpustnost ve vodě
Nerozpustný
Atomové rádio
139 hodin
Atomový objem
13,1 cm3/ mol
Kovalentní poloměr
120 hodin
Specifické teplo
0,328 J / gmol při 20 ° C
Odpařovací teplo
32,4 kJ / mol
Elektronegativita
2,18 na Paulingově stupnici
Ionizační energie
První ionizační energie 946,2 kJ / mol
Oxidační stavy
-3, +3, +5
Stabilita
Elementární arsen je stabilní na suchém vzduchu, ale při vystavení vlhkému vzduchu je pokrytý bronzově žlutou vrstvou, která se může stát černou vrstvou oxidu arsenitého (AsdvaNEBO3).
Rozklad
Když se arzenik zahřeje na rozklad, vydává bílý kouř AsdvaNEBO3. Postup je nebezpečný, protože se může uvolňovat také arsin, velmi jedovatý plyn.
Automatické zapalování
180 ° C
Tvrdost
3,5 na Mohsově stupnici tvrdosti.
Reaktivita
Není napaden studenou kyselinou sírovou nebo koncentrovanou kyselinou chlorovodíkovou. Reaguje s horkou kyselinou dusičnou nebo kyselinou sírovou za vzniku kyseliny arsenové a kyseliny arsenové.
Když se šedý arsen odpaří zahřátím a páry se rychle ochladí, vytvoří se žlutý arsen. To se vrátí do šedavé formy, když je vystaveno ultrafialovému světlu.
Aplikace
Slitiny
Malé množství arsenu přidaného k olovu vytvrzuje jeho slitiny natolik, že je lze použít při potahování kabelů a při výrobě autobaterií..
Přídavek arsenu k mosazi, slitině mědi a zinku, zvyšuje jeho odolnost proti korozi. Na druhé straně koriguje nebo snižuje ztrátu zinku v mosazi, což způsobuje prodloužení jeho životnosti..
elektronika
Vyčištěný arzen se používá v polovodičové technologii, kde se používá ve spojení s gáliem a germaniem, stejně jako ve formě arsenidu gália (GaAs), který je druhým nejpoužívanějším polovodičem.
GaA mají přímou mezeru v pásmu, kterou lze použít při výrobě diod, laserů a LED. Kromě arzenidu gália existují i další arsenidy, jako je arsenid indný a arsenid hlinitý, které jsou rovněž polovodiči III-V..
Mezitím je arsenid kademnatý polovodič typu II-IV. Arsine se používá při dopingu polovodičů.
Zemědělství a ochrana dřeva
Většina aplikací byla vyřazena kvůli jejich vysoké toxicitě a toxicitě jejich sloučenin. EsodvaNEBO3 byl použit jako pesticid, zatímco AsdvaNEBO5 je složkou herbicidů a insekticidů.
Kyselina arsenová (H3AsO4) a soli, jako je arzeničnan vápenatý a arzeničnan olovnatý, byly použity ke sterilizaci půdy a hubení škůdců. To vytváří riziko kontaminace životního prostředí arsenem..
Arzeničnan olovnatý se používal jako insekticid na ovocných stromech až do první poloviny 20. století. Ale kvůli své toxicitě byl nahrazen methylarsenátem sodným, který se od roku 2013 přestal používat ze stejného důvodu.
Léčivý
Až do 20. století se několik jejích sloučenin používalo jako léky. Například arsphenamin a neolsalvarsan se používají při léčbě syfilisu a trypanosomiázy.
V roce 2000 bylo použití AsdvaNEBO3, Vysoce toxická sloučenina při léčbě akutní promyelocytární leukémie rezistentní na kyselinu all-trans retinovou. Nedávno byl použit radioaktivní izotop 74Eso pro lokalizaci nádoru.
Izotop produkuje dobré snímky, jasnější než ty, které byly získány pomocí 124Já, protože jód je přenášen do štítné žlázy a produkuje šum v signálu.
Jiná použití
Arzen se v minulosti používal jako doplňková látka při výrobě drůbeže a prasat.
Používá se jako katalyzátor při výrobě ethylenoxidu. Používá se také při ohňostrojích a opalování. Oxid arzenitý se používá jako odbarvovač při výrobě skla.
Kde se to nachází?
Arzen se nachází v malém množství v elementárním stavu s vysokým stupněm čistoty. Je přítomen v mnoha sloučeninách, jako jsou: sulfidy, arsenidy a sulfoarseniidy.
Vyskytuje se také v několika minerálech, včetně: arsenopyritu (FeSAs), loellingitu (FeAs)dva), enargit (Cu3Osel4), orpiment (AsdvaS3) a realgar (As4S4).
Jak se to získává?
Arsenopyrit se při nedostatku vzduchu zahřeje na 650–700 ° C. Arsen se odpaří a zůstane jako zbytek sulfid železitý (FeS). Během tohoto procesu se arzen spojuje s kyslíkem za vzniku As4NEBO6, známý jako „bílý arsen“.
Eso4NEBO6 je upraven tak, aby tvořil AsdvaNEBO3, jehož páry jsou shromažďovány a kondenzovány v sadě cihelných komor, přičemž arsen je čištěn sublimací.
Většina arsenu se vyrábí redukcí uhlíku na prach vytvořený z AsdvaNEBO3.
Reference
- Stephen R. Marsden. (23. dubna 2019). Chemie arsenu. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (3. prosince 2018). Zajímavá fakta o arsenu. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Arsen. Obnoveno z: en.wikipedia.org
- Dr. Dough Stewart. (2019). Fakta o prvcích arsenu. Chemicool. Obnoveno z: chemicool.com
- Royal Society of Chemistry. (2019). Arsen. Obnoveno z: rsc.or
- Redaktoři Encyclopaedia Britannica. (3. května 2019). Arsen. Encyklopedie Britannica. Obnoveno z: britannica.com


Zatím žádné komentáře