
Struktura azidu sodného (NaN3), vlastnosti, použití, rizika

The Azid sodný je krystalická anorganická pevná látka tvořená sodným iontem Na+ a azidový iont N3-. Jeho chemický vzorec je NaN3. Sloučenina NaN3 je sodná sůl kyseliny hydrazoové HN3. NaN3 je bezbarvá až bílá krystalická pevná látka.
Ačkoli se jedná o velmi toxickou sloučeninu, jedním z nejrozšířenějších použití byly airbagy, které se okamžitě nafouknou při nehodě vozidla. Používá se také k rychlému nafouknutí nouzových skluzů na letadlech. Jeho použití je však v současné době v obou případech velmi zpochybňováno kvůli jeho toxicitě..

Používá se v laboratořích chemického výzkumu k syntéze různých typů sloučenin a v biochemických laboratořích ke studiu bakterií, hub nebo savčích nebo lidských buněk.
V některých laboratořích se používá ke sterilizaci materiálů nebo zařízení, ale některé druhy mikroorganismů odolávají jeho biocidnímu působení.
Používá se také v zemědělství k eliminaci parazitů z půdy nebo v dřevařském průmyslu, aby se zabránilo barvení borovicového dřeva houbami.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Disociační konstanty
- 3.7 Chemické vlastnosti
- 3.8 Biochemické vlastnosti
- 4 Získání
- 5 použití
- 5.1 V motorových vozidlech a letadlech
- 5.2 V chemickém průmyslu
- 5.3 V zemědělství
- 5.4 Při přípravě dalších chemických sloučenin
- 5.5 V průmyslu výbušnin
- 5.6 V biochemických laboratořích
- 5.7 V různých použitích
- 6 Rizika
- 7 Reference
Struktura
NaN azid sodný3 je tvořen kationem sodíku Na+ a azidový anion N3-.
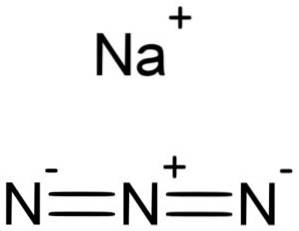
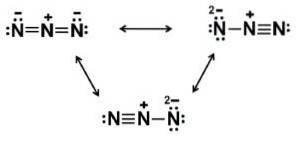
Azidový iont N3- Skládá se ze 3 atomů dusíku (N) spojených dohromady kovalentními vazbami, které mohou být jednoduché, dvojité nebo trojné, protože elektrony jsou sdíleny mezi třemi.
Uvedený anion má lineární strukturu, tj. Tři atomy dusíku uspořádané v přímce. Struktura je navíc symetrická.
Nomenklatura
- Azid sodný
- Azid sodný
Vlastnosti
Fyzický stav
Bezbarvá až bílá krystalická pevná látka. Šestihranné krystaly.
Molekulární váha
65,01 g / mol
Bod tání
Rozkládá se při 275 ° C.
Hustota
1,846 g / cm3 při 20 ° C
Rozpustnost
Je velmi rozpustný ve vodě: 41,7 g / 100 ml při 17 ° C. Je mírně rozpustný v ethanolu a nerozpustný v ethyletheru.
Disociační konstanty
Má pKb ze dne 9.3. Vodné roztoky obsahují NH3, který rychle uniká do prostředí při teplotě 37 ° C.
Chemické vlastnosti
NaN3 je velmi korozivní vůči hliníku a mírně vůči mědi a olovu.
Podle určitého zdroje není azid sodný výbušný. Při zahřátí na 300 ° C nebo více se plynule a úplně rozkládá a vytváří kovový sodík Na a plynný dusík Ndva.
2 NaN3 → 2 Na + 3 Ndva↑
Jedná se o nitridační činidlo, to znamená, že slouží k dusíkání nebo přidání dusíku k jiným chemickým sloučeninám nebo k povrchu materiálů, jako je ocel..
Je stabilní v neutrální nebo alkalické vodě za nepřítomnosti světla. Rozkládá se slunečním zářením.
Biochemické vlastnosti
Azid sodný inhibuje enzym zvaný cytochromoxidáza, který se nachází v mitochondriích buněk a významně se podílí na dýchání a tvorbě energie v tomto.
Jeho působení zabraňuje tvorbě ATP, klíčové sloučeniny v buněčných aktivitách, a buňka se zhoršuje nebo poškozuje.
Při požití, vdechnutí nebo kontaktu s azidem sodným je velmi toxický a může být smrtelný..
Získávání
Amoniak NH reaguje3 s kovovým sodíkem Na při 350 ° C v uzavřené ocelové nádobě, čímž se získá amid sodný NaNHdva.
Amid sodný NaNHdva se nechá reagovat s oxidem dusnýmdvaNebo při 230 ° C v niklovém reaktoru, a tak se vytvoří směs azidu sodného NaN3, hydroxid sodný NaOH a amoniak NH3.
2 NaNHdva + NdvaO → NaN3 + NaOH + NH3
Lze jej také získat reakcí amidu sodného s dusičnanem sodným NaNO3 při 175 ° C:
3 NaNHdva + Starší bratr3 → NaN3 + 3 NaOH + NH3
K vyčištění azidu se ke směsi přidá voda, azidové krystaly se promyjí a poté se voda odpaří. Zbývající krystalický materiál je azid sodný NaN3 který se poté suší při 110 ° C.
Aplikace
V motorových vozidlech a letadlech
Azid sodný se již dlouho používá v automobilovém průmyslu jako generátor dusíku k rychlému nafouknutí airbagů. airbagy) bezpečnost volantů osobních a nákladních vozidel při nárazu.
Používá se také na nafukovacích skluzavkách, které slouží k rychlému úniku z vnitřku letadel, která přistála v nouzových situacích..
V obou případech mechanismus zahrnuje působení jiskry k vyvolání okamžité reakce mezi azidem sodným a určitými sloučeninami za vzniku plynného dusíku Ndva a oxid sodný NadvaNEBO.
V této aplikaci je vyžadováno okamžité uvolnění studeného a netoxického plynu, proto je nejvhodnějším plynem dusík..

Toto použití však klesá kvůli toxicitě azidu sodného a místo toho se používají méně toxické sloučeniny..
V chemickém průmyslu
Používá se jako zpomalovač při výrobě houbové gumy, k zabránění srážení styrenu nebo butadienového latexu při skladování ve styku s kovy a k rozkladu dusitanů v přítomnosti dusičnanů.
V zemědělství
Používá se v zemědělství: jako biocid a fumigant je také nematicidem, to znamená, že se aplikuje na půdy k eliminaci hlístic, což jsou paraziti, kteří napadají některé plodiny.

Fungoval také jako herbicid a jako prevence proti hnilobě ovoce.
Nedávno NaN3 byl použit při přípravě okra nebo semen okra ke sledování jejich odolnosti vůči podmínkám podmáčení.
Semena, na která byl dříve aplikován NaN3 vytvořené sazenice, které odolávaly povodňovým podmínkám lépe než neošetřené, zlepšily výšku rostlin, zvýšily počet listů a zvýšily počet kořenů i při přebytečné vodě.
Při přípravě dalších chemických sloučenin
Používá se jako chemické činidlo při syntéze organických sloučenin, například k přípravě mnoha organických azidů, jako je tosylazid nebo azidy terciárních alkylových skupin, které jsou důležité při chemické syntéze.
Používá se k přípravě kyseliny hydrazoové (HN3) a čistý sodík (Na).
V průmyslu výbušnin
NaN azid sodný3 je meziprodukt při výrobě výbušnin, protože se používá k přípravě azidu olovnatého Pb (N3)dva. Ta druhá je sloučenina, která exploduje, když je zasažena silou, a proto se používá při konstrukci odpalovacích zařízení..

V biochemických laboratořích
Azid sodný se používá, když je vyžadováno sterilní laboratorní vybavení, protože je schopné ničit různé druhy mikroorganismů.
Je to biocidní látka. Některé zdroje však naznačují, že některé druhy bakterií jsou vůči jeho působení rezistentní..
Toho je dosaženo blokováním vazebného místa kyslíku v cytochromoxidáze, což je enzym zapojený do procesu výroby energie některých mikroorganismů..
Používá se v automatických počítačích krve, také při diferenciálním výběru bakterií a k uchování laboratorních roztoků reagencií, protože brání růstu určitých mikroorganismů v těchto.
V různých použitích
Azid sodný se používá v dřevařském průmyslu k zabránění růstu hnědých plísňových skvrn na borovém dřevě..
Používá se také v japonském pivním průmyslu, aby se zabránilo vývoji plísní, které pivo ztmaví..
Rizika
Azid sodný je toxická sloučenina, která inhibuje enzym důležitý pro dýchání a život lidských a zvířecích buněk. Bylo zjištěno, že může vážně ovlivnit buňky mozkové tkáně cév.
Okamžitým účinkem po požití, vdechnutí nebo kontaktu s pokožkou je nebezpečné snížení krevního tlaku, které může vést k úmrtí. Proto s ním musí být zacházeno velmi opatrně..
Existují zdroje informací, které upozorňují na airbagy vozidel zničených v odpadních oblastech.
V takových případech by k vkladům NaN měli přístup lidé, kteří si toho nebezpečí nejsou vědomi.3, to je velmi toxická sloučenina. Kromě toho existuje nebezpečí kontaminace NaN3 půdy a vody.
Podobně by při nehodách, srážkách nebo požárech vozidel mohli být lidé vystaveni působení NaN3 a toto může být podceňováno nebo neznámo zdravotnickým personálem účastnícím se pohotovosti.
Pozornost byla rovněž věnována expozici laboratorního personálu, který jej používá.
Reference
- Vwioko, E.D. et al. (2019). Azid sodný jako základ zvyšuje toleranci namáčení namáhání v Okře (Abelmoschus esculentus). Agronomy 2019, 9, 670. Obnoveno z mdpi.com.
- Kho, D.T. et al. (2017). Smrt endoteliálních buněk bariéry krevního mozku na azid sodný a jeho plynné produkty. Biosenzory 2017, 7, 41. Obnoveno z mdpi.com.
- NÁS. Národní lékařská knihovna. (2019). Azid sodný. Obnoveno z: pubchem.ncbi.nlm.nih.gov.
- Talavera, M. a kol. (2019). Správa hlístic v jahodových polích jižního Španělska. Agronomy 2019, 9, 252. Obnoveno z mdpi.com.
- Okano, T. a kol. (devatenáct devadesát pět). Mechanismus oddělení buněk od teplotně modulovaných hydrofilně-hydrofobních polymerních povrchů. In The Biomaterials: Silver Jubilee Compendium. Obnoveno ze sciencedirect.com.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. Svazek A22. VCH Verlagsgesellschaft mbH.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Chang, S. a Lamm, S.H. (2003). Účinky expozice azidu sodnému na lidské zdraví: Přehled a analýza literatury. Int J Toxicol 2003, 22 (3): 175-86. Obnoveno z ncbi.nlm.nih.gov.


Zatím žádné komentáře