
Charakteristické základy a příklady

The základny jsou to všechny ty chemické sloučeniny, které mohou přijímat protony nebo darovat elektrony. V přírodě nebo uměle existují anorganické i organické báze. Proto lze jeho chování předvídat pro mnoho iontových molekul nebo pevných látek..
Co však odlišuje základnu od zbytku chemických látek, je její výrazná tendence darovat elektrony ve srovnání například s druhy chudými v elektronové hustotě. To je možné pouze v případě, že je umístěn elektronický pár. V důsledku toho mají báze oblasti bohaté na elektrony, δ-.

Jaké organoleptické vlastnosti umožňují identifikaci bází? Obvykle se jedná o žíravé látky, které fyzickým kontaktem způsobují těžké popáleniny. Zároveň mají mýdlový nádech a snadno rozpouštějí tuky. Kromě toho jsou jeho příchutě hořké.
Kde jsou v každodenním životě? Komerčním a rutinním zdrojem základů jsou čisticí prostředky, od detergentů po ruční mýdla. Z tohoto důvodu může obraz bublin suspendovaných ve vzduchu pomoci zapamatovat si báze, i když za nimi je mnoho fyzikálně-chemických jevů..
Mnoho bází vykazuje zcela odlišné vlastnosti. Například některé mají špinavý a silný zápach, například organické aminy. Jiné na druhé straně, jako je čpavek, pronikají a dráždí. Mohou to být také bezbarvé kapaliny nebo iontové bílé pevné látky..
Všechny zásady však mají jednu společnou věc: reagují s kyselinami za vzniku rozpustných solí v polárních rozpouštědlech, jako je voda..
Rejstřík článků
- 1 Charakteristika základen
- 1.1 Fyzikální vlastnosti
- 1.2 Pevnost základny
- 1,3 pH vyšší než 7
- 1.4 Schopnost neutralizovat kyseliny
- 1,5 Redukční kapacita oxidu
- 1.6 Uvolněte OH-
- 1.7 Mají atomy dusíku nebo substituenty, které přitahují elektronovou hustotu
- 2 Příklady bází
- 2,1 NaOH
- 2.2 CH3OCH3
- 2.3 Hydroxidy alkalických kovů
- 2.4 Organické základy
- 2,5 NaHCO3
- 3 Odkazy
Charakteristika základen

Kromě toho, co již bylo zmíněno, jaké specifické vlastnosti by měly mít všechny základny? Jak mohou přijmout protony nebo darovat elektrony? Odpověď spočívá v elektronegativitě atomů molekuly nebo iontu; a mezi všemi z nich je převládající kyslík, zvláště když se zjistí jako hydroxylový ion, OH-.
Fyzikální vlastnosti
Báze mají kyselou chuť a jsou s výjimkou amoniaku bez zápachu. Jeho struktura je kluzká a má schopnost měnit barvu lakmusového papíru na modrou, methylooranžovou na žlutou a fenolftaleinovou na fialovou..
Pevnost základny
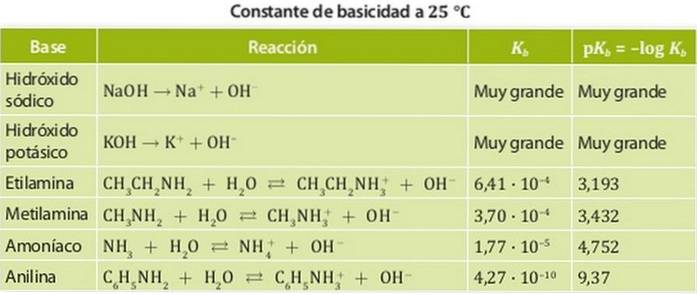
Báze se dělí na silné a slabé. Síla báze je spojena s její rovnovážnou konstantou, proto se v případě bází tyto konstanty nazývají konstanty zásadnosti Kb.
Silné báze tedy mají velkou konstantu bazicity, takže mají tendenci se úplně disociovat. Příkladem těchto kyselin jsou alkálie, jako je hydroxid sodný nebo draselný, jejichž bazické konstanty jsou tak velké, že je nelze měřit ve vodě..
Na druhou stranu je slabá báze ta, jejíž disociační konstanta je nízká, takže je v chemické rovnováze.
Příkladem jsou amoniak a aminy, jejichž konstanty kyselosti jsou řádově 10-4. Obrázek 1 ukazuje různé konstanty kyselosti pro různé báze.
pH vyšší než 7
Stupnice pH měří hladinu alkality nebo kyselosti roztoku. Stupnice se pohybuje od nuly do 14. pH nižší než 7 je kyselé. PH vyšší než 7 je zásadité. Střed 7 představuje neutrální pH. Neutrální roztok není ani kyselý, ani zásaditý.
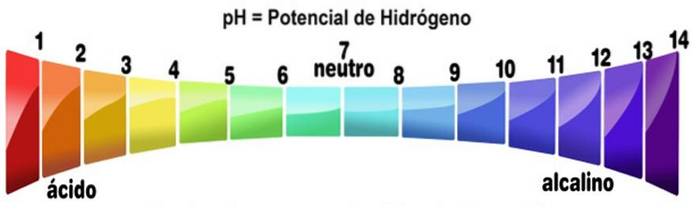
Stupnice pH se získá jako funkce koncentrace H+ v řešení a je tomu nepřímo úměrné. Báze snižováním koncentrace protonů zvyšují pH roztoku.
Schopnost neutralizovat kyseliny
Arrhenius ve své teorii navrhuje, aby kyseliny tím, že jsou schopné generovat protony, reagovaly s hydroxylem bází za vzniku soli a vody následujícím způsobem:
HCl + NaOH → NaCl + HdvaNEBO.
Tato reakce se nazývá neutralizace a je základem analytické techniky zvané titrace..
Kapacita redukce oxidu
Vzhledem k jejich schopnosti produkovat nabité druhy se báze používají jako médium pro přenos elektronů v redoxních reakcích..
Báze mají také tendenci oxidovat, protože mají schopnost darovat volné elektrony..
Báze obsahují ionty OH. Mohou jednat a darovat elektrony. Hliník je kov, který reaguje se zásadami.
2 Al + 2NaOH + 6HdvaO → 2NaAl (OH)4+3Hdva
Nekorodují mnoho kovů, protože kovy mají tendenci spíše ztrácet než přijímat elektrony, ale báze jsou vysoce korozivní pro organické látky, jako jsou ty, které tvoří buněčnou membránu..
Tyto reakce jsou obvykle exotermické, což při kontaktu s pokožkou způsobuje těžké popáleniny, takže s tímto typem látky je třeba zacházet opatrně. Obrázek 3 je bezpečnostní indikátor, pokud je látka žíravá.

Uvolňují OH-
Za prvé, OH- Může být přítomen v mnoha sloučeninách, zejména v hydroxidech kovů, protože ve společnosti kovů má tendenci „chňapnout“ protony za vzniku vody. Bází tedy může být jakákoli látka, která uvolňuje tento iont v roztoku prostřednictvím rovnováhy rozpustnosti:
M (OH)dva <=> Mdva+ + 2OH-
Pokud je hydroxid velmi rozpustný, rovnováha je zcela posunuta napravo od chemické rovnice a mluvíme o silné bázi. M (OH)dva , místo toho je to slabá báze, protože zcela neuvolňuje své OH ionty- ve vodě. Jednou OH- vyrobený může neutralizovat jakoukoli kyselinu, která je kolem ní:
Ach- + HA => A- + HdvaNEBO
A tak OH- deprotonuje kyselinu HA a přeměňuje se na vodu. Proč? Protože atom kyslíku je velmi elektronegativní a má také přebytek elektronové hustoty v důsledku záporného náboje.
O má tři páry volných elektronů a může darovat kterýkoli z nich částečně kladně nabitému atomu H, δ +. Stejně tak velká energetická stabilita molekuly vody upřednostňuje reakci. Jinými slovy: HdvaNebo je mnohem stabilnější než HA, a pokud je to pravda, dojde k neutralizační reakci.
Konjugované základny
A co OH- již-? Oba jsou základny, s tím rozdílem, že A- je konjugovaná báze kyselina HA. Dále A- je mnohem slabší báze než OH-. Odtud je možné dospět k následujícímu závěru: základna reaguje a vytváří slabší.
Základna Silný + Kyselina Silný => Základna Slabý + Kyselina Slabý
Jak je patrné z obecné chemické rovnice, totéž platí pro kyseliny.
Konjugovaná základna A- může deprotonovat molekulu v reakci známé jako hydrolýza:
NA- + HdvaNEBO <=> HA + OH-
Na rozdíl od OH-, po neutralizaci vodou vytváří rovnováhu. Opět je to proto, že A- je to mnohem slabší báze, ale dost na to, aby způsobila změnu pH roztoku.
Proto všechny ty soli, které obsahují A- jsou známé jako bazické soli. Příkladem je uhličitan sodný, NadvaCO3, který po rozpuštění zalkalizuje roztok hydrolýzou:
CO3dva- + HdvaNEBO <=> HCO3- + Ach-
Mají atomy dusíku nebo substituenty, které přitahují elektronovou hustotu
Základem nejsou jen iontové pevné látky s anionty OH- ve své krystalové mřížce mohou mít také další elektronegativní atomy, jako je dusík. Tyto typy bází patří do organické chemie a mezi nejběžnější patří aminy.
Co je to aminová skupina? R-NHdva. Na atomu dusíku je nesdílený elektronický pár, který může, stejně jako OH-, deprotonovat molekulu vody:
R-NHdva + HdvaNEBO <=> RNH3+ + Ach-
Rovnováha je vysoce posunuta doleva, protože amin, i když je zásaditý, je mnohem slabší než OH-. Všimněte si, že reakce je podobná reakci dané molekule amoniaku:
NH3 + HdvaNEBO <=> NH4+ + Ach-
Pouze aminy nemohou správně vytvořit kation, NH4+; ačkoli RNH3+ je amonný kation s monosubstitucí.
A může reagovat s jinými sloučeninami? Ano, s každým, kdo má dostatečně kyselý vodík, i když reakce neprobíhá úplně. To znamená, že reaguje pouze velmi silný amin, aniž by nastala rovnováha. Podobně mohou aminy darovat svůj pár elektronů jiným druhům než H (jako jsou alkylové radikály: -CH3).
Báze s aromatickými kruhy
Aminy mohou mít také aromatické kruhy. Pokud lze jeho pár elektronů uvnitř kruhu „ztratit“, protože kruh přitahuje elektronovou hustotu, jeho bazicita se sníží. Proč? Protože čím více je uvedený pár ve struktuře, tím rychleji bude reagovat s druhy chudými na elektrony.
Například NH3 je základní, protože jeho pár elektronů nemá kam jít. Totéž platí pro aminy, ať už jsou primární (RNHdva), sekundární (R.dvaNH) nebo terciární (R3N). Ty jsou zásaditější než amoniak, protože kromě toho, co bylo právě vysvětleno, dusík přitahuje vyšší elektronovou hustotu substituentů R, čímž zvyšuje δ-.
Pokud však existuje aromatický kruh, může v něm uvedená dvojice vstoupit do rezonance, což znemožňuje účast na tvorbě vazeb s H nebo jinými druhy. Aromatické aminy proto mají tendenci být méně bazické, pokud elektronový pár nezůstává fixován na dusíku (jako u pyridinové molekuly).
Příklady bází
NaOH
Hydroxid sodný je jednou z nejpoužívanějších bází po celém světě. Jeho aplikací je nespočet, ale mezi nimi můžeme zmínit jeho použití k zmýdelnění některých tuků a tím k výrobě základních solí mastných kyselin (mýdel).
CH3OCH3
Strukturálně se může zdát, že aceton nepřijímá protony (nebo nedává elektrony), přesto to dělá, přestože je to velmi slabá báze. Je to proto, že elektronegativní atom O přitahuje elektronové mraky skupin CH.3, zdůrazňující přítomnost svých dvou párů elektronů (: O :).
Alkalické hydroxidy
Kromě NaOH jsou hydroxidy alkalických kovů také silné báze (s malou výjimkou LiOH). Mezi jinými základnami tedy existují:
-KOH: hydroxid draselný nebo žíravý potaš, je to jedna z nejpoužívanějších bází v laboratoři nebo v průmyslu, díky své velké odmašťovací schopnosti.
-RbOH: hydroxid rubidia.
-CsOH: hydroxid cesný.
-FrOH: hydroxid francium, jehož bazicita je teoreticky považována za jednu z nejsilnějších, jaké kdy byly známy.
Organické základy
-CH3CHdvaNHdva: ethylamin.
-LiNHdva: amid lithný. Spolu s amidem sodným, NaNHdva, jsou jednou z nejsilnějších organických bází. V nich amidový anion, NHdva- je to báze, která deprotonuje vodu nebo reaguje s kyselinami.
-CH3ONa: methoxid sodný. Tady je základna anion CH3NEBO-, které mohou reagovat s kyselinami za vzniku methanolu, CH3Ach.
-Grignardova činidla: mají atom kovu a halogen, RMX. V tomto případě je radikál R bází, ale ne právě proto, že odnáší kyselý vodík, ale proto, že se vzdá svého páru elektronů, které sdílí s atomem kovu. Například: ethylmagnesiumbromid, CH3CHdvaMgBr. Jsou velmi užitečné při organické syntéze.
NaHCO3
Jedlá soda se používá k neutralizaci kyselosti za mírných podmínek, například uvnitř úst jako přísada do zubních past.
Reference
- Merck KGaA. (2018). Organické základy. Převzato z: sigmaaldrich.com
- Wikipedia. (2018). Báze (chemie). Převzato z: es.wikipedia.org
- Chemistry 1010. Acids and Bases: What They Are and Where They Found. [PDF]. Převzato z: cactus.dixie.edu
- Kyseliny, zásady a stupnice pH. Převzato z: 2.nau.edu
- Skupina Bodner. Definice kyselin a zásad a úloha vody. Převzato z: chemed.chem.purdue.edu
- Chemistry LibreTexts. Základny: Vlastnosti a příklady. Převzato z: chem.libretexts.org
- Shiver & Atkins. (2008). Anorganická chemie. Na Kyseliny a zásady. (čtvrté vydání). Mc Graw Hill.
- Helmenstine, Todde. (4. srpna 2018). Názvy 10 základen. Obnoveno z: thoughtco.com

Zatím žádné komentáře