
Struktura kyseliny disulfurové, vlastnosti, názvosloví a použití
The kyselina disulfurová je jednou z mnoha oxokyselin síry, jejíž chemický vzorec je HdvaSdvaNEBO7. Vzorec výslovně uvádí, že existují dva atomy síry, a jak jeho název také naznačuje, musí existovat dvě molekuly HdvaSW4 jen jeden; místo osmi je však sedm kyslíků, takže síra musí mít tři.
Tato kyselina je považována za jednu z hlavních složek oleum (nebo dýmavou kyselinu sírovou), což je „hustá“ forma kyseliny sírové. Taková je jeho převaha, že někteří považují oleum za synonymum pro kyselinu disulfurovou; který je také známý pod tradičním názvem kyselina pyrosulfurová.

Obrázek ukazuje nádobu s oleem o koncentraci oxidu sírového, SO3, na 20%. Tato látka se vyznačuje tím, že je mastná a bezbarvá; i když může nažloutnout nebo zhnědnout v závislosti na koncentraci SO3 a přítomnost některých nečistot.
Výše uvedené se týká účasti SN3 v HdvaSdvaNEBO7; tj. molekula HdvaSW4 reagovat SO3 za vzniku kyseliny disulfurové. V tomto případě tedy HdvaSdvaNEBO7 lze také napsat jako HdvaSW4· SW3.
Rejstřík článků
- 1 Struktura kyseliny disulfurové
- 2 Vlastnosti
- 2.1 Reakce dehydratace cukru
- 3 Názvosloví
- 4 použití
- 4.1 Uchovává kyselinu sírovou
- 4.2 Syntéza 100% kyseliny sírové
- 4.3 Sulfonace
- 5 Reference
Struktura kyseliny disulfurové
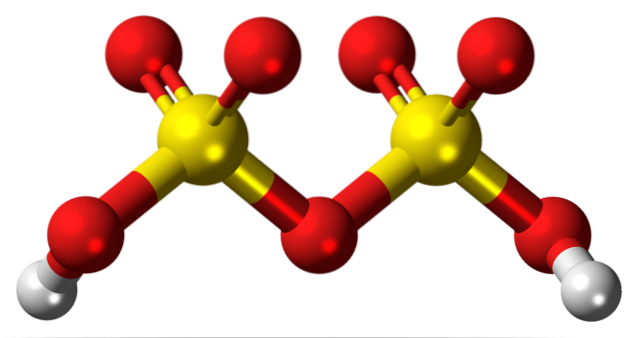
Nahoře je struktura HdvaSdvaNEBO7 v modelu koulí a tyčí. Na první pohled si všimněte symetrie molekuly: levá strana kyslíkového můstku je identická s pravou. Z tohoto pohledu lze strukturu popsat pomocí vzorce HO3SOSO3H.
Na obou koncích je každá hydroxylová skupina, jejíž vodík indukčním účinkem všech těchto atomů kyslíku zvyšuje svůj kladný parciální náboj; a následně má kyselina disulfurová ještě silnější kyselost než kyselina sírová.
Molekula může být zapsána jako HdvaSW4· SW3. To se však týká spíše složení oleu než struktury molekuly..
Pokud je však k H přidána molekula vodydvaSdvaNEBO7, uvolní se dvě molekuly HdvaSW4:
HdvaSdvaNEBO7 + HdvaNEBO <=> 2HdvaSW4
Rovnováha se může posunout doleva: ke vzniku HdvaSdvaNEBO7 od H.dvaSW4 pokud je do něj dodáváno teplo. Z tohoto důvodu je v HdvaSdvaNEBO7 je také známá jako kyselina pyrosulfurová; protože se může vytvářet po zahřátí kyseliny sírové.
Jak již bylo uvedeno na začátku, HdvaSdvaNEBO7 je tvořen přímou kombinací HdvaSW4 A tak3:
SW3 + HdvaSW4 <=> HdvaSdvaNEBO7
Vlastnosti
Vlastnosti kyseliny disulfurové nejsou přesně definovány, protože je extrémně obtížné izolovat čistě z oleum.
Je třeba si uvědomit, že v oleu mohou být další sloučeniny se vzorcem HdvaSW4XSO3, kde v závislosti na hodnotě x můžete mít dokonce polymerní struktury.
Jedním ze způsobů, jak si to představit, je představit si, že horní struktura HdvaSdvaNEBO7 se prodlužuje o další jednotky SO3 a kyslíkové můstky.
V téměř čistém stavu sestává z nestabilní (dýmavé) krystalické pevné látky, která taje při 36 ° C. Tato teplota tání se však může lišit v závislosti na skutečném složení..
Kyselina disulfurová může tvořit takzvané disulfátové (nebo pyrosulfátové) soli. Například pokud reaguje s hydroxidem draselným, tvoří pyrosulfát draselný, K.dvaSdvaNEBO7.
Kromě toho lze poznamenat, že má molekulovou hmotnost 178 g / mol a dva ekvivalenty kyselin (2 H ionty+ které lze neutralizovat silnou základnou).
Reakce dehydratace cukru
S touto sloučeninou ve formě oleum lze provést zvědavou reakci: přeměnu kostek cukru na uhlíkové bloky.
HdvaSdvaNEBO7 reaguje s cukry a vylučuje všechny jejich OH skupiny ve formě vody, což upřednostňuje nové vazby mezi atomy uhlíku; klouby, které nakonec způsobí černý uhlík.
Nomenklatura
Kyselina disulfurová je považována za anhydrid kyseliny sírové; to znamená, že ztrácí molekulu vody v důsledku kondenzace mezi dvěma molekulami kyseliny. Vzhledem k tolika možným názvům pro tuto sloučeninu nomenklatura IUPAC jednoduše doporučuje kyselinu disulfurovou..
Termín „pyro“ se vztahuje výlučně na produkt vytvořený jako produkt aplikace tepla. IUPAC nedoporučuje tento název pro H.dvaSdvaNEBO7; ale dnes je stále používán mnoha chemiky.
Konec -ico zůstává nezměněn, protože atom síry si nadále udržuje valenci +6. Například jej lze vypočítat pomocí následující aritmetické operace:
2H + 2S + 7O = 0
2 (+1) + 2S + 7 (-2) = 0
S = 6
Aplikace
Uchovává kyselinu sírovou
Kyselina disulfurová je díky své vlastnosti tuhnutí jako oleum schopna bezpečněji se rozpouštět a ukládat kyselinu sírovou. Je to proto, že OS3 uniká a vytváří nedýchatelnou „mlhu“, která je v H mnohem rozpustnějšídvaSW4 než ve vodě. Chcete-li získat HdvaSW4, stačilo by přidat vodu do oleum:
HdvaSdvaNEBO7 + HdvaNEBO <=> 2HdvaSW4
100% syntéza kyseliny sírové
Z výše uvedené rovnice je HdvaSW4 zředí se přidanou vodou. Například pokud máte vodný roztok HdvaSW4, kde SO3 Má sklon k úniku a představuje riziko pro pracovníky.Pokud se do roztoku přidá oleum, reaguje s vodou a vytváří více kyseliny sírové. to znamená zvýšení vaší koncentrace.
Pokud zůstane trochu vody, přidá se více SO3, který reaguje s HdvaSW4 produkovat více kyseliny disulfurové nebo oleum, a pak se rehydratuje „sušením“ HdvaSW4. Proces se opakuje dostatečně často, aby se získala kyselina sírová v koncentraci 100%.
Podobný postup se používá k získání 100% kyseliny dusičné. Podobně se používá k dehydrataci dalších chemických látek používaných k výrobě výbušnin..
Sulfonace
Používá se k sulfonaci struktur, jako jsou struktury barviv; to znamená přidat -SO skupiny3H, který se ztrátou kyselého protonu může ukotvit na polymeru textilního vlákna.
Na druhou stranu se kyselost oleum používá k dosažení druhé nitrace (přidat -NO skupinydva) na aromatické kruhy.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2018). Kyselina disulfurová. Obnoveno z: en.wikipedia.org
- PubChem. (2019). Kyselina pyrosulfurová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Seong Kyu Kim, Han Myoung Lee a Kwang S. Kim. (2015). Kyselina disulfurová disociovaná dvěma molekulami vody: výpočty funkční teorie ab initio a hustoty. Phys. Chem. Chem. Phys., 2015, 17, 28556
- Contra Costa Health Services. (s.f.). Oleum / oxid sírový: chemický přehled. [PDF]. Obnoveno z: cchealth.org



Zatím žádné komentáře