
Struktura bromidu lithného, vlastnosti, použití, rizika
The bromid lithný je to neutrální sůl alkalického kovu, jejíž chemický vzorec je LiBr. Vzorec vyjadřuje, že jeho krystalická pevná látka je složena z iontů Li+ a Br- v poměru 1: 1. Jeho krystaly jsou bílé nebo světle béžové. Je velmi rozpustný ve vodě a je to také poměrně hygroskopická sůl..
Tato poslední vlastnost umožňuje jeho použití jako vysoušedla v klimatizačních a chladicích systémech. Podobně byl bromid lithný používán od počátku 20. století při léčbě některých poruch duševního zdraví, jeho používání bylo upuštěno kvůli nevhodnému použití soli.
LiBr se vyrábí zpracováním uhličitanu lithného, LidvaCO3, s kyselinou bromovodíkovou. Po zahřátí média se vysráží z vodného roztoku jako hydrát..
Tato sůl dráždí pokožku a oči při kontaktu a při vdechování způsobuje podráždění dýchacích cest. Požití solí lithia může způsobit nevolnost, zvracení, průjem a závratě.
Rejstřík článků
- 1 Struktura bromidu lithného
- 1.1 Hydráty a brýle
- 2 Vlastnosti
- 2.1 Molekulová hmotnost
- 2.2 Vzhled
- 2.3 Zápach
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Rozpustnost ve vodě
- 2.7 Rozpustnost v organických rozpouštědlech
- 2.8 Index lomu (ηD)
- 2.9 Tepelná kapacita
- 2.10 Standardní molární entropie (Sθ 298)
- 2.11 Bod vzplanutí
- 2.12 Stabilita
- 2.13 Rozklad
- 2,14 pH
- 2.15 Reaktivita
- 2.16 Výroba
- 3 Názvosloví
- 4 použití
- 4.1 Vysoušedlo
- 4.2 Vlákna
- 4.3 Farmaceutické výrobky
- 4.4 Sedativum
- 5 Rizika
- 5.1 Kontaktní toxicita
- 5.2 Požití
- 6 Reference
Struktura bromidu lithného
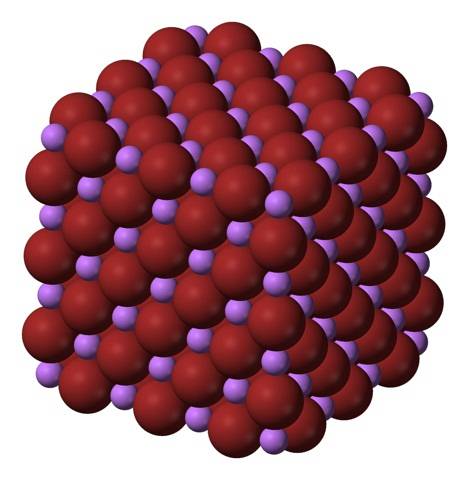
Vzorec LiBr jasně ukazuje, že poměr Li / Br je roven 1; pro každý Li kation+ musí existovat brionský anion- protějšek. Proto musí být tento poměr udržován konstantní ve všech rozích krystalu LiBr..
Li ionty+ a Br- přitahují se navzájem a snižují odpor mezi stejnými náboji, aby tak vznikl krychlový krystal jako drahokamová sůl; toto je izomorfní s NaCl (horní obrázek). Všimněte si, že celá sada má sama o sobě kubickou geometrii.
V tomto krystalu Li+ jsou menší a mají světle fialovou barvu; zatímco Br- jsou objemnější a tmavě hnědé barvy. Je pozorováno, že každý ion má šest sousedů, což je stejné jako říkat, že představují oktaedrickou koordinaci: LiBr6 nebo Li6Br; pokud se však uvažuje o jednotkové buňce, poměr Li / Br zůstává 1.
Toto je krystalová struktura, kterou přednostně přijímá LiBr. Může však také tvořit jiné typy krystalů: wurzit, pokud krystalizuje při nízkých teplotách (-50 ° C) na substrátu; nebo kubický centrovaný na tělo nebo typ CsCl, pokud je krystal kubické drahokamy vystaven vysokému tlaku.
Hydráty a brýle
Výše uvedené platí pro bezvodý LiBr. Tato sůl je hygroskopická, a proto může absorbovat vlhkost z prostředí a vkládat molekuly vody do svých vlastních krystalů. Vznikají tedy hydráty LiBrnHdvaO (n = 1, 2, 3…, 10). U každého hydrátu je krystalová struktura odlišná.
Například krystalografické studie určily, že LiBrHdvaNebo přijměte strukturu podobnou perovskitu.
Když jsou tyto hydráty ve vodném roztoku, mohou podchlazovat a vitrifikovat; to znamená, že přijmou zdánlivě krystalickou, ale molekulárně narušenou strukturu. Za takových podmínek jsou vodíkové vazby ve vodě velmi důležité..
Vlastnosti
Molekulární váha
88,845 g / mol.
Vzhled
Bílá nebo světle béžová krystalická pevná látka.
Zápach
Toaleta.
Bod tání
552 ° C (1026 ° F, 825 K).
Bod varu
1256 ° C (2309 ° F, 1538 K).
Rozpustnost ve vodě
166,7 g / 100 ml při 20 ° C Všimněte si jeho vysoké rozpustnosti.
Rozpustnost v organických rozpouštědlech
Rozpustný v methanolu, ethanolu, etheru a acetonu. Mírně rozpustný v pyridinu, aromatické sloučenině a méně polární než předchozí.
Index lomu (ηD)
1784.
Kalorická kapacita
51,88 J / mol K..
Standardní molární entropie (S.θ 298)
66,9 J / mol K..
bod vznícení
1265 ° C Je považován za nehořlavý.
Stabilita
Stabilní. Bezvodá forma je však extrémně hygroskopická.
Rozklad
Při rozkladu zahříváním produkuje oxid lithný.
pH
Mezi pH 6 a 7 ve vodném roztoku (100 g / L, 20 ° C).
Reaktivita
Bromid lithný není za normálních podmínek prostředí reaktivní. Se zvyšováním teploty však můžete zažít silné reakce se silnými kyselinami..
Při rozpouštění ve vodě dochází ke zvýšení teploty způsobené negativní entalpií hydratace.
Výroba
LiBr se vyrábí reakcí hydroxidu lithného nebo uhličitanu lithného s kyselinou bromovodíkovou v neutralizační reakci:
LidvaCO3 + HBr => LiBr + COdva + HdvaNEBO
Bromid lithný se získá jako hydrát. Pro získání bezvodé formy je nutné zahřát hydratovanou sůl ve vakuu..
Nomenklatura
Název „bromid lithný“ je odvozen od skutečnosti, že jde o halogenid kovu, který je tak pojmenován podle základní nomenklatury. Jiné názvy, stejně platné, ale méně používané, jsou podle systematické nomenklatury monobromid lithný; a bromid lithný (jedinečná valence +1 pro lithium) podle tradiční nomenklatury.
Aplikace
Vysoušedlo
LiBr je hygroskopická sůl, která tvoří koncentrovanou solanku schopnou absorbovat vlhkost ze vzduchu v širokém rozmezí teplot. Tato solanka se používá jako vysoušedlo v klimatizačních a chladicích systémech..
Vlákna
Používá se ke zvýšení objemu vlny, vlasů a dalších organických vláken.
Farmaceutické přípravky
LiBr tvoří adukty s některými farmaceutickými sloučeninami a moduluje jejich působení. Adukt je kombinace koordinace dvou nebo více molekul, aniž by došlo ke strukturální změně kterékoli ze spojených molekul.
Sedativní
Bromid lithný byl poprvé použit jako sedativum při určitých duševních poruchách a byl přerušen v roce 1940. V současné době se používá uhličitan lithný; ale v každém případě je lithium prvkem, který působí terapeuticky v obou sloučeninách.
Lithium se používá při léčbě bipolární poruchy, což je užitečné při kontrole manických epizod poruchy. Předpokládá se, že lithium inhibuje aktivitu excitačních neurotransmiterů, jako je dopamin a kyselina glutamová.
Na druhou stranu zvyšuje aktivitu inhibičního systému zprostředkovaného neurotransmiterem kyselina gama-aminomáselná (GABA). Tyto účinky by mohly být součástí základu terapeutického působení lithia.
Rizika
Kontaktní toxicita
Podráždění a senzibilizace kůže, alergie. Vážné poškození očí nebo podráždění očí, dýchacích cest, nosních cest a krku.
Požití
Mezi hlavní příznaky požití bromidu lithného patří: gastrointestinální poruchy, zvracení a nevolnost. Mezi další nepříznivé účinky požití soli patří neklid, křeče a ztráta vědomí..
Stav známý jako „bromismus“ může nastat při dávkách bromidu lithného vyšších než 225 mg / den..
Ve vtipech se mohou objevit některé z následujících příznaků: příznaky exacerbace akné a nechutenství, třes, problémy s řečí, apatie, slabost a maniakální neklid.
Reference
- Chemická formulace. (2019). Bromid lithný. Obnoveno z: formulacionquimica.com
- David C. Johnson. (10. července 2008). Nová objednávka na bromid lithný. Příroda. doi.org/10.1038/454174a
- Aayushi Jain & R.C. Dixit. (s.f.). Strukturní fázový přechod v bromidu lithném: Vliv tlaku a teploty. [PDF]. Obnoveno z: ncpcm.in
- Takamuku a kol. (1997). Rentgenové difrakční studie na podchlazeném vodném roztoku lithia a bromidu lithného. Katedra chemie, Přírodovědecká fakulta, Fukuoka University, Nanakuma, Jonan-ku, Fukuoka 814-80, Japonsko.
- Národní centrum pro biotechnologické informace. (2019). Bromid lithný. PubChem Database, CID = 82050. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Bromid lithný. Obnoveno z: en.wikipedia.org
- Royal Society of Chemistry. (2019). Bromid lithný. Chemspider. Obnoveno z: chemspider.com


Zatím žádné komentáře