
Struktura, vlastnosti a použití bromidu sodného (NaBr)
The bromid sodný je to chemická látka, která patří mezi soli anorganického původu. Jeho struktura je složena z halogenového bromu a kovového prvku sodíku v poměru 1: 1. Jeho chemický vzorec je NaBr a je v pevném stavu agregace za standardních teplotních a tlakových podmínek (25 ° C a 1 atm).
Normálně jej lze považovat za bílý prášek a je považován za sloučeninu krystalického typu, která také vykazuje hygroskopické chování; to znamená, že má schopnost absorbovat vlhkost ze svého okolí.

Podobně má bromid sodný velmi podobné fyzikální vlastnosti jako jiná iontová sloučenina stejného kovu: chlorid sodný. Tento chlorid je reprezentován jako NaCl, který je běžněji známý jako běžná sůl nebo kuchyňská sůl..
Má velké množství použití v různých oblastech vědy; Například se používá při výrobě různých druhů drog (sedativa, hypnotika, antikonvulziva, mimo jiné), stejně jako v organických syntézách a dokonce i ve fotografických aplikacích..
Rejstřík článků
- 1 Chemická struktura
- 1.1 Chemická syntéza
- 2 Vlastnosti
- 3 použití
- 4 Odkazy
Chemická struktura
Jak již bylo zmíněno výše, bromid sodný se vyskytuje v pevné fázi a stejně jako mnoho jiných anorganických solí má krystalickou strukturní konformaci..
Tato krystalická molekula, složená z atomu bromu a vodíku, má konformaci kubického typu zaměřenou na obličej, jako jsou soli stejného kovu halogenidového typu (NaI, NaF a NaCl).
Toto molekulární uspořádání tvoří strukturní základ mnoha sloučenin, ve kterých se uspořádání provádí takovým způsobem, že každý iont zůstává ve středu oktaedrického obrazce, jak je znázorněno na následujícím obrázku.
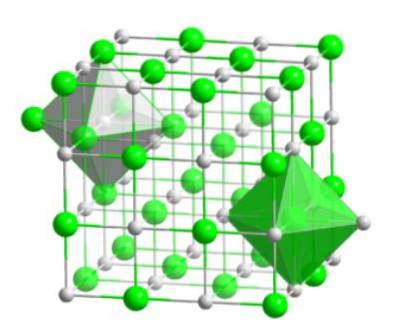
U tohoto typu krystalu lze pozorovat, jak má každý z iontů kolem sebe šest dalších iontů - které mají opačný elektrický náboj - které jsou umístěny na koncích oktaedrického obrazce..
Struktura této iontové látky rovněž naznačuje, že má vysokou teplotu tání přibližně 747 ° C a komerčně se vyskytuje ve dvou formách: bezvodá látka (bez molekul vody) a dihydrát (se dvěma molekulami vody ve strukturní formě). vzorec (NaBr 2HdvaO)), jehož teploty tání jsou různé.
Chemická syntéza
Bromid sodný pochází z chemické reakce, která probíhá mezi bromovodíkem (BrH, halogenovodík v plynné fázi) a hydroxidem sodným (NaOH, silná báze v pevné fázi a s hygroskopickými vlastnostmi).
Tímto způsobem se vyrábí komerčně přidáním přebytku bromu k roztoku NaOH. Tak se vytvoří směs bromid / brom. Následně se výsledné produkty podrobí odpařování do sucha a zpracují se s uhlíkem za vzniku reakce redukce iontů bromičnanu (BrO3-) na bromidový ion (Br-).
Neutralizace
Podobně může být tato anorganická sůl také vyrobena neutralizační reakcí uhličitanu sodného (NadvaCO3) s kyselinou bromovou (HBrO3), stejným postupem popsaným výše.
Pomocí syntézy je možné tuto látku vyrobit reakcí mezi železem a bromem a vodou. Jako produkt této reakce vzniká druh bromidu železnatého a železitého.
Později se tento druh vytvořil (reprezentován jako FeBrdva/ FeBr3) se rozpustí ve vodě a přidá se k ní určité množství uhličitanu sodného. Nakonec se roztok filtruje a prochází odpařovacím procesem, aby se nakonec získal bromid sodný..
Vlastnosti
- Obvykle se vyskytuje v pevném stavu agregace ve formě bílého prášku.
- Má krystalickou strukturu s molekulárním uspořádáním ve tvaru krychle se středem na tvářích.
- Teplota tání této látky je přibližně 747 ° C pro její bezvodou formu a 36 ° C pro její dihydrátovou formu, což před rozkladem představuje rozklad..
- Je tvořen sodíkovým iontem (Na+) a bromidový ion (Br-), s molární hmotností nebo molekulovou hmotností 102,89 g / mol.
- Jeho bod varu je poměrně vysoký, pozorovaný při 1390 ° C (ekvivalent k 2530 ° F nebo 1660 K).
- Rozpustnost tohoto druhu je kolem 94,32 g / 100 ml ve vodě při 25 ° C a zvyšuje se s rostoucí teplotou..
- Při zahřátí na místo, kde se rozkládá, uvolňuje tato látka plyny bromu a oxidu sodného, které jsou považovány za toxické..
- Hustota bezvodé formy bromidu sodného je 3,21 g / cm3, zatímco obsah dihydrátové sloučeniny je 2,18 g / cm3.
- Jeho rozpustnost v alkoholu je považována za střední, stejně jako v jiných rozpouštědlech, jako je pyridin, amoniak a hydrazin.
- Představuje nerozpustnost proti acetonitrilu a acetonu.
Aplikace
- V medicíně se používá jako lék na velké množství stavů, které způsobují záchvaty, a jako léčba k prevenci epilepsie u pacientů s Wolf-Hirschhornovým syndromem, jakož i při sedativní a hypnotické léčbě..
- Ve veterinární medicíně se používá u psů, kteří mají záchvaty v důsledku vedlejších účinků léků, jako je primidon nebo fenobarbital.
- V oblasti ropného průmyslu se používá při přípravě určitých kapalin různé hustoty, které se používají v ropných vrtech..
- V oblasti biologického výzkumu byly prokázány jeho mikrobiocidní vlastnosti; to znamená, že se používá k řízení vývoje různých druhů bakterií.
- V některých syntézách organického typu se tato anorganická sůl používá k přípravě jiných druhů skládajících se z bromu. Například pomocí Finkelsteinovy reakce se získají určité vyšší reaktivity alkylhalogenidy, z nichž jeden byl široce používán ve fotografii..
- V oblasti čištění a dezinfekce se bromid sodný používá v kombinaci s chlorem k sanitaci velkého množství vody, například v bazénech a vířivkách..
Reference
- Wikipedia. (s.f.). Bromid sodný. Obnoveno z en.wikipedia.org
- PubChem. (s.f.). Bromid sodný. Citováno z pubchem.ncbi.nlm.nih.gov
- Johnson, A. W. (1999). Pozvánka na organickou chemii. Obnoveno z books.google.co.ve
- Science Direct. (s.f.). Bromid sodný. Citováno z sciencedirect.com
- Riviere, J. E. a Papich, M. G. (2009). Veterinární farmakologie a terapeutika. Obnoveno z books.google.co.ve



Zatím žádné komentáře