
Struktura, charakteristiky a funkce kadherin
The kadheriny jsou to na vápníku závislé transmembránové glykoproteiny odpovědné za udržování spojení mezi buňkami, které umožňují udržovat integritu tkání u zvířat. Existuje více než 20 různých typů kadherinů, všechny s přibližně 750 aminokyselinami, které jsou specifické pro různé typy buněk..
Spojení buněk dosažené kadheriny jsou časem stabilní. Proto tyto molekuly hrají důležitou roli při vývoji tvaru organismu během embryonálního vývoje (morfogeneze), jakož i při udržování struktury tkání jak v embryonálním stadiu, tak v dospělosti..
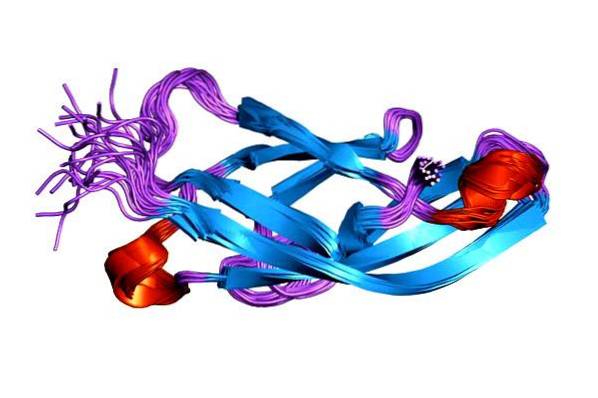
Porucha funkce kadherinů je spojena s vývojem různých typů rakoviny. Deficit buněčné adheze kadheriny je jednou z příčin zvýšené motility nádorových buněk.
Rejstřík článků
- 1 Molekuly adheze buněk
- 2 Historie
- 3 Struktura
- 4 typy
- 4.1 Klasické kadherinky nebo typ I
- 4.2 Atypické nebo kadheriny typu II
- 5 Funkce
- 6 funkcí
- 7 Kadheriny a rakovina
- 8 Reference
Molekuly buněčné adheze
V mnohobuněčných organismech se buňky musí spojit, aby se účastnily velké rozmanitosti biologických procesů, které umožňují udržení jejich integrity, a tím se odlišují od jednobuněčných koloniálních organismů. Mezi tyto procesy patří mimo jiné hemostáza, imunitní odpověď, morfogeneze a diferenciace..
Tyto molekuly se liší svou strukturou i funkcí do čtyř skupin: integriny, selektiny, imunoglobuliny a kadheriny..
Příběh
Historie kadherinů je velmi krátká, protože jsou známy jen krátkou dobu. První kadherin byl tedy objeven v buňkách z myších tkání v roce 1977. Vědci tuto molekulu nazvali uvomorulin.
V 80. letech bylo v tkáních různých druhů objeveno mnoho dalších molekul kadherinu. Tyto kadheriny byly nalezeny v testech agregace buněk závislých na vápníku. Všechny patřily do stejné skupiny molekul nazývaných klasické kadheriny..
V posledních letech a díky pokroku v molekulární biologii se vědcům podařilo identifikovat další důležitý počet kadherinů, z nichž některé nejsou známy jejich specifické funkce a které by mohly mít jiné funkce než buněčnou adhezi.
Struktura
Kadheriny jsou glykoproteiny, tj. Molekuly vytvořené asociací bílkovin a sacharidů. Jsou tvořeny mezi 700 (obvykle 750) a 900 aminokyselinami a mají různé funkční domény, které jim umožňují interakci s jinými molekulami kadherinu a především s ionty vápníku..
Funkční domény také umožňují integraci kadherinů do plazmatické membrány a také jejich asociaci s aktinovým cytoskeletem. Většina aminokyselinových řetězců je umístěna v extracelulární oblasti a obvykle se liší do pěti domén nazývaných EC (EC1 - EC5).
Každá z těchto domén má přibližně 100 aminokyselin s jedním nebo dvěma místy vázajícími vápník. Transmembránová oblast se nachází mezi vnější a vnitřní částí buňky a prochází membránou pouze jednou.
Na druhou stranu je část kadherinů nalezená uvnitř buňky vysoce konzervativní a skládá se ze 150 aminokyselin. Tato doména se váže na cytoskelet aktinu prostřednictvím cytosolických proteinů nazývaných cateniny..
Typy
Existuje více než 20 různých typů kadherinů, které jsou klasifikovány různými způsoby v závislosti na autorech. Někteří autoři tak například rozpoznávají dvě skupiny nebo podskupiny, zatímco jiní šest. Podle prvního lze kadheriny rozdělit na:
Klasické kadherinky nebo typ I.
Také se jim říká tradiční kadheriny. Do této skupiny jsou zahrnuty kadheriny, které byly pojmenovány podle tkáně, kde byly poprvé nalezeny, jako je E-kadherin (epiteliální), N-kadherin (neurální), P-kadherin (placentární), L-kadherin (játra) a R-kadherin (sítnice). Tyto glykoproteiny však lze nalézt v různých tkáních..
Například N-kadherin, kromě toho, že je přítomen v nervové tkáni, může být také lokalizován v tkáních varlat, ledvin, jater a srdečního svalstva..
Atypické nebo kadheriny typu II
Také se nazývá netradiční nebo netradiční. Zahrnují desmogleiny a desmocholiny, které tvoří spojení na úrovni mezibuněčných desmosomů. Existují také protocadheriny, které se vyznačují nedostatečným spojením s aktinovým cytoskeletem.
Všechny tyto kadheriny jsou některými autory odděleny od ostatních netradičních do tří nezávislých skupin. Zbytek atypických kadherinů zahrnuje T-kadherin, který postrádá transmembránové a cytoplazmatické domény, a variantu E-kadherinu, který se nachází mimo buňku a nazývá se Evar-kadherin..
Vlastnosti
Jsou to na vápníku závislé glykoproteiny, které se nacházejí téměř výlučně ve zvířecích tkáních. Většina z nich je jednoprůchodová transmembránová; to znamená, že jsou přítomny v buněčné membráně a procházejí ji ze strany na stranu pouze jednou.
Kadheriny se účastní hlavně spojení mezi buňkami, které vykazují semilární fenotypové vlastnosti (homotypické nebo homofilní vazby). Buněčné vazby vytvořené těmito molekulami (vazby kadherin-kadherin) jsou asi 200krát silnější než jiné vazby protein-protein..
U tradičních kadherinů je cytoplazmatická doména vysoce konzervativní. To znamená, že jeho složení je u různých kadherinů podobné..
Funkce
Hlavní funkcí kadherinů je umožnit trvalé buněčné spoje v průběhu času, pro které hrají zásadní roli v procesech, jako je embryonální vývoj, morfogeneze, diferenciace a strukturální udržování epiteliálních tkání v kůži a střevech, stejně jako tvorba axonů.
Tato funkce je částečně regulována terminálem -COOH přítomným v intracelulární části nebo doméně glykoproteinu. Tento terminál interaguje s molekulami zvanými cateniny, které zase interagují s prvky cytoskeletu buněk.
Mezi další funkce kadherinů patří selektivita (volba, ke které další buňce se má připojit) a buněčná signalizace, stanovení polarity buněk a regulace apoptózy. Posledně jmenovaný je mechanismus buněčné smrti řízený interně stejným organismem, který reguluje jeho vývoj.
Kadheriny a rakovina
Porucha kadherinů se podílí na vývoji různých typů rakoviny. Tato porucha může být způsobena změnami v expresi kadherinů a katechinů a také aktivací signálů, které brání buňkám ve spojení..
Tím, že selhává buněčná vazba kadherinů, umožňuje to nádorovým buňkám zvýšit jejich pohyblivost a uvolnit se, aby pak mohly napadnout sousední tkáně lymfatickými uzlinami a cévami.
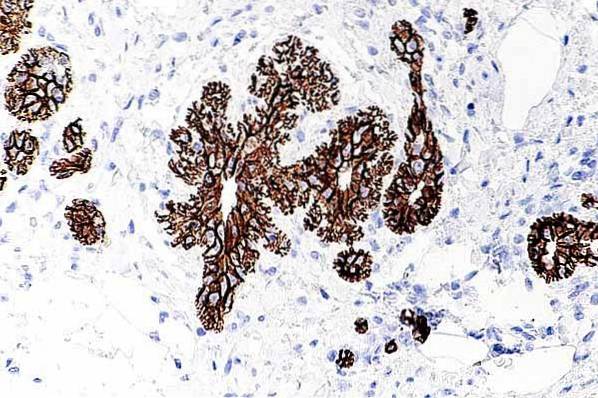
Když se tyto buňky dostanou do cílových orgánů, napadnou je a množí se a získají invazivní a metastatické znaky. Většina prací, které mají vztah kadherinů k procesům karcinogenního růstu, se zaměřila na E-kadherin.
Tento typ kadherinu se mimo jiné účastní rakoviny tlustého střeva, žaludku, prsu, vaječníků a plic. To však není jediný kadherin spojený s rakovinou. Například N-kadherin hraje roli v pleurálních mezoteliomech a rhabdomyosarkomech.
Reference
- Cadherin. Na Wikipedii. Obnoveno z en.wikipedia.org
- D. Leckband a A. Prakasam (2006). Mechanismus a dynamika adheze kadherinu. Roční přehled biomedicínského inženýrství.
- F. Nolletl, P. Kools P a F. Van Roy (2000). Fylogenetická analýza nadrodiny kadherinů umožňuje identifikaci šesti hlavních podrodin vedle několika osamělých členů. Journal of Molecular Biology.
- J. Günther a E. Pedernera-Astegiano (2011). E-kadherin: klíčový prvek v neoplastické transformaci. Journal of Evidence and Clinical Research.
- L. Petruzzelli, M. Takami a D. Humes (1999). Struktura a funkce molekul adheze buněk. American Journal of Medicine.
- U. Cavallaro & G. Christofori (2004). Buněčná adheze a signalizace kadheriny a Ig-CAM u rakoviny. Nature Reviews Cancer.



Zatím žádné komentáře