
Koncept citlivý na teplo, vzorce a řešená cvičení
The citelné horko je tepelná energie dodávaná do předmětu, která způsobí jeho zvýšení teploty. Je to opak latentního tepla, při kterém tepelná energie nezvyšuje teplotu, ale spíše podporuje fázovou změnu, například z pevné na kapalnou..
Příklad objasňuje koncept. Předpokládejme, že máme hrnec s vodou o pokojové teplotě 20 ° C. Když ji položíme na kamna, dodané teplo pomalu zvyšuje teplotu vody, dokud nedosáhne 100 ° C (teplota varu vody na hladině moře). Dodávané teplo se nazývá citelné teplo.

Jakmile voda dosáhne bodu varu, teplo dodávané hořákem již nezvyšuje teplotu vody, která zůstává na 100 ° C. V tomto případě se dodaná tepelná energie investuje do odpařování vody. Dodávané teplo je latentní, protože nezvyšovalo teplotu, ale místo toho způsobilo změnu z kapalné fáze do plynné fáze.
Je experimentální skutečností, že citelné teplo nutné k dosažení určité teplotní změny je přímo úměrné této změně a hmotnosti objektu..
Rejstřík článků
- 1 Koncept a vzorce
- 1.1 Adiabatický koeficient γ
- 1.2 Tepelná kapacita C
- 1.3 Specifické teplo v pevných látkách, kapalinách a plynech
- 2 Rozdíl s latentním teplem
- 2.1 Jak vypočítat latentní teplo?
- 3 Vyřešená cvičení
- 3.1 Příklad 1
- 3.2 Příklad 2
- 3.3 Příklad 3
- 4 Odkazy
Koncept a vzorce
Bylo pozorováno, že kromě hmoty a teplotního rozdílu závisí citelné teplo také na materiálu. Z tohoto důvodu se konstanta úměrnosti mezi citelným teplem a produktem hmoty a teplotní rozdíl nazývá specifické teplo.
Množství dodaného citelného tepla závisí také na tom, jak se proces provádí. Například je jiné, pokud se proces provádí při konstantním objemu než při konstantním tlaku.
Vzorec pro citelné teplo v procesu isobarický, tj. při stálém tlaku je to následující:
Q = cp . m (T.F - Ti)
Ve výše uvedené rovnici Q je citelné teplo dodávané do hmotného objektu m, který zvýšil svoji počáteční teplotu Ti až do konečné hodnoty Tf. Ve výše uvedené rovnici se také objeví Cp, což je specifické teplo materiálu při stálém tlaku, protože proces byl prováděn tímto způsobem.
Pamatujte také, že citelné teplo je pozitivní, když je absorbováno objektem a způsobuje zvýšení teploty..
V případě, že je teplo dodáváno do plynu uzavřeného v pevné nádobě, bude postup izochorický, tj. při stálém objemu; a vzorec pro citelné teplo bude napsán takto:
Q = cproti. m. (T.F - Ti)
Adiabatický koeficient γ
Kvocient mezi specifickým teplem při konstantním tlaku a specifickým teplem při konstantním objemu pro stejný materiál nebo látku se nazývá adiabatický koeficient, což se obvykle označuje řeckým písmenem gama γ.
The adiabatický koeficient je větší než jednota. Teplo potřebné ke zvýšení teploty tělesa o hmotnosti jednoho gramu o jeden stupeň je větší v izobarickém procesu než v izochorickém..
Je to proto, že v prvním případě se část tepla používá k provádění mechanických prací.
Kromě měrného tepla je často definována také tepelná kapacita těla. Toto je množství tepla potřebné ke zvýšení teploty těla o jeden stupeň Celsia.
Tepelná kapacita C.
Tepelná kapacita je označena C velké písmeno, zatímco specifické teplo s C malá písmena. Vztah mezi oběma veličinami je:
C = c⋅ m
Kde m je hmotnost těla.
Používá se také molární měrné teplo, které je definováno jako množství citelného tepla potřebné ke zvýšení teploty jednoho molu látky o jeden stupeň Celsia nebo Kelvina..
Specifické teplo v pevných látkách, kapalinách a plynech
Molární měrné teplo většiny pevných látek má hodnotu blízkou 3 krát R, kde R je univerzální plynová konstanta. R = 8,314472 J / (mol ℃).
Například hliník má molární specifické teplo 24,2 J / (mol ℃), Měď 24,5 J / (mol ℃), zlato 25,4 J / (mol ℃), a sladké železo 25,1 J / (mol ℃). Všimněte si, že tyto hodnoty jsou blízké 3R = 24,9 J / (mol ℃).
Naproti tomu u většiny plynů je molární specifické teplo blízké n (R / 2), kde je n celé číslo a R je univerzální plynová konstanta. Celé číslo n souvisí s počtem stupňů volnosti molekuly, která tvoří plyn.
Například v ideálním monatomickém plynu, jehož molekula má pouze tři translační stupně volnosti, je molární specifické teplo při konstantním objemu 3 (R / 2). Pokud se ale jedná o ideální diatomický plyn, existují navíc dva stupně rotace, takže Cproti = 5 (R / 2).
V ideálních plynech platí následující vztah mezi molárním měrným teplem při konstantním tlaku a konstantním objemu: Cp = cproti + R.
Zvláštní zmínku si zaslouží voda. V kapalném stavu při 25 ° C má voda Cp = 4,1813 J / (g ℃), vodní pára při 100 stupních Celsia má Cp = 2 080 J / (g ℃) a ledová voda má nulový stupeň Celsia Cp = 2050 J / (g ℃).
Rozdíl s latentním teplem
Hmota může být ve třech stavech: pevná látka, kapalina a plyn. Ke změně stavu je zapotřebí energie, ale každá látka na ni reaguje jiným způsobem podle svých molekulárních a atomových charakteristik..
Když se pevná látka taje nebo se odpařuje kapalina, teplota předmětu zůstává konstantní, dokud všechny částice nezmění svůj stav..
Z tohoto důvodu je možné, aby látka byla v rovnováze ve dvou fázích: například pevná látka - kapalina nebo kapalina - pára. Množství látky může přejít z jednoho stavu do druhého přidáním nebo odstraněním malého množství tepla, zatímco teplota zůstává pevná..
Teplo dodávané do materiálu způsobuje, že jeho částice vibrují rychleji a zvyšují jejich kinetickou energii. To se promítne do zvýšení teploty.
Je možné, že získaná energie je tak velká, že se již nevrátí do své rovnovážné polohy a vzdálenost mezi nimi se zvětší. Když k tomu dojde, teplota se nezvyšuje, ale látka přechází z pevné látky do kapaliny nebo z kapaliny do plynu.
Teplo potřebné k tomu je známé jako latentní teplo. Latentní teplo je tedy teplo, kterým látka může měnit fázi.
Zde je rozdíl oproti citelnému teplu. Látka, která absorbuje citelné teplo, zvyšuje jeho teplotu a zůstává ve stejném stavu.
Jak vypočítat latentní teplo?
Latentní teplo se vypočítá z rovnice:
Q = m. L
Kde L může to být specifické výparné teplo nebo teplo fúze. Jednotky L jsou energie / hmotnost.
Vědci pojmenovali teplo četnými jmény, v závislosti na typu reakce, které se účastní. Jedná se například o reakční teplo, teplo spalování, teplo tuhnutí, teplo roztoku, teplo sublimace a mnoho dalších..
Hodnoty mnoha z těchto druhů tepla pro různé látky jsou uvedeny v tabulce.
Vyřešená cvičení
Příklad 1
Předpokládejme, že má kus hliníku o hmotnosti 3 kg. Zpočátku je to 20 ° C a chcete zvýšit jeho teplotu na 100 ° C. Vypočítejte potřebné citelné teplo.
Řešení
Nejprve musíme znát měrné teplo hliníku
Cp = 0,897 J / (g ° C)
Pak bude množství tepla potřebné k ohřátí kusu hliníku
Q = cp m (Tf - Ti) = 0,897 * 3000 * (100 - 20) J
Q = 215 280 J
Příklad 2
Vypočítejte množství tepla potřebné k ohřevu 1 litru vody z 25 ° C na 100 ° C na úrovni hladiny moře. Výsledek vyjádřete také v kilokalóriích.
Řešení
První věc, kterou si musíte pamatovat, je, že 1 litr vody váží 1 kg, tj. 1000 gramů.
Q = cp m (Tf - Ti) = 4,1813 J / (g ℃) * 1000 g * (100 ℃ - 25 ℃) = 313597,5 J
Kalorie je jednotka energie, která je definována jako citelné teplo potřebné ke zvýšení gramu vody o jeden stupeň Celsia. Proto se 1 kalorie rovná 4,1813 Joulu.
Q = 313597,5 J * (1 cal / 4,1813 J) = 75000 cal = 75 kcal.
Příklad 3
360,16 gramů materiálu se zahřeje z 37 140 na 140 ℃. Dodaná tepelná energie je 1150 kalorií.
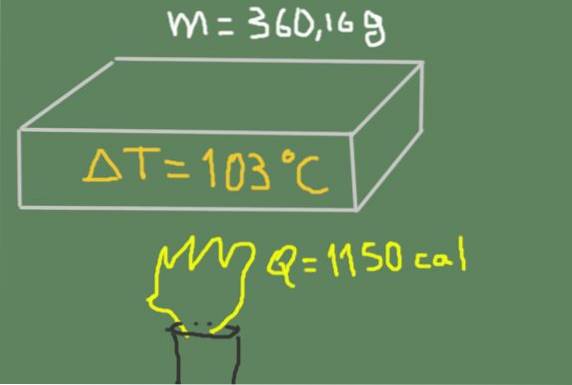
Najděte specifické teplo materiálu.
Řešení
Měrné teplo můžeme zapsat jako funkci citelného tepla, hmotnosti a kolísání teploty podle vzorce:
Cp = Q / (m ΔT)
Nahrazením dat máme následující:
Cp = 1150 kcal / (360,16 g * (140 ℃ - 37 ℃)) = 0,0310 kcal / (g ℃)
Ale protože jedna kalorie se rovná 4,1813 J, lze výsledek vyjádřit také jako
Cp = 0,130 J / (g ℃)
Reference
- Giancoli, D. 2006. Fyzika: Principy s aplikacemi. 6th. Ed. Prentice Hall. 400 - 410.
- Kirkpatrick, L. 2007. Fyzika: Pohled na svět. 6ta Zkrácené vydání. Cengage Learning. 156 - 164.
- Tippens, P. 2011. Fyzika: koncepty a aplikace. 7. Přepracované vydání. McGraw Hill. 350 - 368.
- Rex, A. 2011. Základy fyziky. Pearson. 309 - 332.
- Sears, Zemansky. 2016. Univerzitní fyzika s moderní fyzikou. 14th. Hlasitost 1. 556 - 553.
- Serway, R., Vulle, C. 2011. Základy fyziky. 9na Cengage Learning. 362 - 374.



Zatím žádné komentáře