
Molekulární struktura kyanovodíku, vlastnosti, použití
The kyselina kyanovodíková nebo kyanovodík je organická sloučenina, jejíž chemický vzorec je HCN. Je také známý jako methanonitril nebo formonitril a ještě před několika lety jako kyselina prusová, i když ve skutečnosti jde o další sloučeninu.
Kyselina kyanovodíková je extrémně jedovatý bezbarvý plyn, který se získává zpracováním kyanidů kyselinami. Tato kyselina se nachází uvnitř semene broskví, také známých na mnoha místech jako broskve..

Při okolní teplotě nižší než 25 ° C je to kapalina a nad touto teplotou je to plyn. V obou případech je extrémně toxický pro člověka, zvířata a dokonce i pro většinu mikroorganismů, které se na něj neaklimatizovaly. Je to dobré rozpouštědlo pro ionty. Je velmi nestabilní, protože má tendenci snadno polymerovat.
Nachází se v rostlinné říši zabudované do molekul některých glykosidů, protože když jsou hydrolyzovány rostlinnými enzymy, získá se HCN, glukóza a benzaldehyd..
Tyto glykosidy jsou v semenech určitých druhů ovoce, jako jsou broskve, meruňky, třešně, švestky a hořké mandle, takže by nikdy neměly být přijímány..
Vyskytuje se také v rostlinných glykosidech, jako jsou některé druhy čiroku. Některé bakterie ho také produkují během svého metabolismu. Používá se hlavně při výrobě polymerů a v některých metalurgických procesech.
HCN je smrtelný jed při vdechování, požití a kontaktu. Je přítomen v cigaretovém kouři a v kouři z ohně plastů a materiálů, které obsahují uhlík a dusík. Považuje se za látku znečišťující ovzduší, protože se produkuje při spalování organického materiálu z velkých oblastí planety.
Rejstřík článků
- 1 Molekulární struktura a elektronická konfigurace
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Teplota samovznícení
- 3.7 Hustota
- 3.8 Rozpustnost
- 3.9 Disociační konstanta
- 3.10 Některé chemické vlastnosti
- 3.11 Korozivita
- 4 Poloha v přírodě
- 5 použití
- 5.1 Při přípravě dalších chemických sloučenin a polymerů
- 5.2 Různá použití
- 5.3 V zemědělství
- 6 Rizika
- 6.1 Mechanismus smrtelného působení v těle
- 6.2 Riziko cigaretového kouře
- 6.3 Rizika ohřevu HCN
- 6.4 Přítomnost HCN v požárním kouři
- 6.5 Látka znečišťující ovzduší
- 7 Reference
Molekulární struktura a elektronická konfigurace
Kyselina kyanovodíková nebo kyanovodík je kovalentní molekulární sloučenina s jedním vodíkem, jedním uhlíkem a jedním atomem dusíku..
Atom uhlíku a atom dusíku sdílejí 3 páry elektronů, takže tvoří trojnou vazbu. Vodík je vázán na uhlík, který s touto vazbou představuje svoji valenci čtyř a celý elektronový oktet.
Dusík má valenci pět a pro doplnění oktetu má dvojici nepárových nebo osamělých elektronů umístěných bočně.
HCN je tedy zcela lineární molekula s nepárovým párem elektronů umístěných laterálně v dusíku..
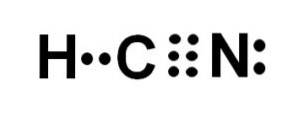
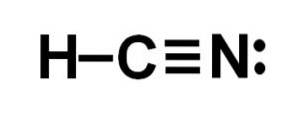
Nomenklatura
- Kyselina kyanovodíková
- Kyanovodík
- Methanonitril
- Formonitril
- Kyselina kyanovodíková
Vlastnosti
Fyzický stav
Pokud je pod 25,6 ° C, je-li bezvodý a stabilizovaný, je to bezbarvá nebo světle modrá kapalina, která je velmi nestabilní a toxická. Pokud je nad touto teplotou, jedná se o extrémně jedovatý bezbarvý plyn.
Molekulární váha
27,03 g / mol
Bod tání
-13,28 ° C
Bod varu
25,63 ° C (mějte na paměti, že vře těsně nad pokojovou teplotou).
Bod vzplanutí
-18 ° C (metoda uzavřeného kelímku)
Teplota samovznícení
538 ° C
Hustota
0,6875 g / cm3 při 20 ° C
Rozpustnost
Plně mísitelný s vodou, ethylalkoholem a ethyletherem.
Disociační konstanta
K = 2,1 x 10-9
pKna = 9,2 (je to velmi slabá kyselina)
Některé chemické vlastnosti
HCN má velmi vysokou dielektrickou konstantu (107 až 25 ° C). Je to proto, že jeho molekuly jsou velmi polární a sdružují se prostřednictvím vodíkových vazeb, jako v případě vody HdvaNEBO.
Díky své vysoké dielektrické konstantě se HCN ukazuje jako dobré ionizující rozpouštědlo..
Bezvodý kapalný HCN je velmi nestabilní, má tendenci prudce polymerovat. Aby se tomu zabránilo, přidávají se stabilizátory, jako je malé procento HdvaSW4.
Ve vodném roztoku a za přítomnosti amoniaku a vysokého tlaku vytváří adenin, sloučeninu, která je součástí DNA a RNA, tj. Biologicky důležitou molekulu.
Je to velmi slabá kyselina, protože její ionizační konstanta je velmi malá, takže ve vodě ionizuje jen částečně a dává kyanidový anion CN-. Vytváří soli s bázemi, ale ne s uhličitany.
Jeho vodné roztoky nechráněné před světlem se pomalu rozkládají za vzniku mravenčanu amonného HCOONH4.
V roztoku má slabý mandlový zápach.
Žíravost
Jelikož je to slabá kyselina, obecně není korozivní.
Avšak vodné roztoky HCN, které obsahují kyselinu sírovou jako stabilizátor, silně napadají ocel při teplotách nad 40 ° C a nerezovou ocel při teplotách nad 80 ° C..
Kromě toho mohou zředěné vodné roztoky HCN způsobovat napětí na uhlíkové oceli i při pokojové teplotě..
Může také napadnout některé typy pryží, plastů a povlaků.
Poloha v přírodě
V rostlinné říši se vyskytuje poměrně hojně jako součást glykosidů.
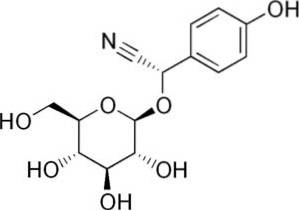
Například je generován z amygdalinu C.6H5-CH (-CN) -O-glukóza-O-glukóza, sloučenina přítomná v hořkých mandlích. Amygdalin je kyanogenní beta-glukosid, protože při hydrolyzaci tvoří dvě molekuly glukózy, jednu z benzaldehydu a jednu z HCN. Enzym, který je uvolňuje, je beta-glukoxidáza.
Amygdalin lze nalézt v semenech broskví, meruněk, hořkých mandlí, třešní a švestek..
Některé druhy rostlin čiroku obsahují kyanogenní glykosid durrin (tj. P-hydroxy- (S) -mandelonitril-beta-D-glukosid). Tato sloučenina může být degradována dvoustupňovou enzymatickou hydrolýzou.
Za prvé, enzym durrináza, který je endogenní v rostlinách čiroku, jej hydrolyzuje na glukózu a p-hydroxy- (S) -mandelonitril. Ten se potom rychle převede na volný HCN a p-hydroxybenzaldehyd.

HCN je zodpovědný za odolnost rostlin čiroku vůči škůdcům a patogenům.
To je vysvětleno skutečností, že durrin a enzym durrináza mají v těchto rostlinách různá umístění a přicházejí do styku, pouze když jsou tkáně poškozeny nebo zničeny, uvolňují HCN a chrání rostlinu před infekcemi, které by mohly proniknout poškozenou částí..
Navíc některé lidské patogenní bakterie, jako je Pseudomonas aeruginosa Y P. gingivalis produkují jej během své metabolické aktivity.
Aplikace
Při přípravě dalších chemických sloučenin a polymerů
Použití, které zahrnuje většinu HCN produkovaného na průmyslové úrovni, je příprava meziproduktů pro organickou syntézu..
Používá se při syntéze adiponitrilu NC- (CHdva)4-CN, který se používá k výrobě nylonu nebo nylonu, polyamidu. Používá se také k přípravě akrylonitrilu nebo kyanoethylenu CHdva= CH-CN, používaný k přípravě akrylových vláken a plastů.
Jeho derivát kyanid sodný NaCN se používá k těžbě zlata při těžbě tohoto kovu.
Další z jeho derivátů, chlorkyan, ClCN, se používá pro pesticidní přípravky.
HCN se používá k přípravě chelatačních činidel, jako je EDTA (ethylen-diamin-tetra-acetát).
Používá se k výrobě ferokyanidů a některých farmaceutických produktů.
Různá použití
Plyn HCN se používá jako insekticid, fungicid a dezinfekční prostředek k fumigaci lodí a budov. Také fumigovat nábytek za účelem jeho obnovy.
HCN se používá při leštění kovů, galvanickém pokovování kovů, fotografických procesech a metalurgických procesech..
Díky své vysoké toxicitě byl označen jako bojový chemický prostředek..
V zemědělství
Používá se jako herbicid a pesticid v sadech. Používal se k hubení šupin a jiných patogenů na citrusových stromech, ale někteří z těchto škůdců se stali rezistentními vůči HCN.
Používá se také k fumigaci sila na obilí. Plyn HCN připravený na místě se používá k fumigaci pšeničných zrn k jejich ochraně před škůdci, jako je hmyz, houby a hlodavci. Pro toto použití je zásadní, aby fumigovaná semena tolerovala pesticidní látku..
Testování bylo provedeno postřikem pšeničných semen HCN a bylo zjištěno, že to nemá negativní vliv na jejich klíčivost, spíše se zdá, že to upřednostňuje..
Vysoké dávky HCN však mohou významně zkrátit délku malých listů, které vyrůstají ze semene..
Na druhé straně, vzhledem k tomu, že se jedná o silný nematicid a že některé rostliny čiroku ho mají ve svých tkáních, zkoumá se možnost použití rostlin čiroku jako biocidního zeleného hnoje..
Jeho použití by sloužilo ke zlepšení půdy, potlačení plevele a potírání chorob a škod způsobených fytoparazitickými hlísticemi..
Rizika
Pro člověka je HCN smrtelný jed ve všech směrech: vdechování, požití a kontakt..

Vdechnutí může být smrtelné. Odhaduje se, že asi 60-70% populace dokáže detekovat hořký mandlový zápach HCN, když je ve vzduchu v koncentraci 1-5 ppm.
Existuje však 20% populace, která to nedokáže detekovat ani při smrtelných koncentracích, protože to geneticky nedokáže.
Požití je to akutní a okamžitě působící jed..
Pokud jejich roztoky přijdou do styku s pokožkou, může být přidružený kyanid smrtelný.
HCN je přítomen v cigaretovém kouři a ten vzniká při spalování plastů obsahujících dusík.
Smrtící mechanismus účinku v těle
Je to chemický asfyxiátor a je rychle toxický, často vede k smrti. Po vstupu do těla se váže na metaloenzymy (enzymy, které obsahují kovový iont) a deaktivuje je. Je to toxické činidlo pro různé orgány lidského těla
Jeho hlavní toxický účinek spočívá v inhibici buněčného dýchání, protože deaktivuje enzym, který ovlivňuje fosforylaci v mitochondriích, což jsou organely, které zasahují mimo jiné do respirační funkce buněk..
Riziko cigaretového kouře
HCN je přítomen v cigaretovém kouři.
Ačkoli mnoho lidí ví o otravném účinku HCN, jen málo lidí si uvědomuje, že jsou vystaveni jeho škodlivému účinku prostřednictvím cigaretového kouře..
HCN je jednou z příčin inhibice několika buněčných respiračních enzymů. Množství HCN přítomné v cigaretovém kouři má obzvláště škodlivý účinek na nervový systém..
Úrovně HCN v cigaretovém kouři byly hlášeny mezi 10 a 400 μg na cigaretu pro přímo inhalovaný kouř a 0,006 až 0,27 μg / cigaretu pro sekundární inhalaci (pasivní kouření). HCN vyvolává toxické účinky od 40 μM dále.

Při vdechování rychle vstupuje do krevního řečiště, kde se uvolňuje do plazmy nebo se váže na hemoglobin. Malá část se přemění na thiokyanát a vylučuje se močí.
Rizika ohřevu HCN
Dlouhodobé vystavení kapalnému HCN teplu v uzavřených nádobách může způsobit neočekávané násilné prasknutí nádob. Může polymerovat výbušně při 50-60 ° C v přítomnosti stopových množství alkálie a v nepřítomnosti inhibitorů.
Přítomnost HCN v kouři z požárů
HCN se uvolňuje během spalování polymerů obsahujících dusík, například vlny, hedvábí, polyakrylonitrilů a nylonu. Tyto materiály jsou přítomny v našich domovech a na většině míst lidské činnosti.
Z tohoto důvodu může být během požárů HCN potenciálně příčinou smrti při vdechování..
Znečištění ovzduší
HCN je znečišťující látkou troposféry. Je odolný vůči fotolýze a za okolních podmínek atmosféry nepodléhá hydrolýze.
Fotochemicky vyrobené hydroxylové OH • radikály mohou reagovat s HCN, ale reakce je velmi pomalá, takže poločas HCN v atmosféře je 2 roky.
Při spalování biomasy, zejména rašeliny, se HCN uvolňuje do atmosféry a také při průmyslových činnostech. Spalování rašeliny je však 5 až 10krát více znečišťující než spalování jiných druhů biomasy.
Někteří vědci zjistili, že vysoké teploty a sucho způsobené fenoménem El Niño v určitých oblastech planety zhoršují sezónní požáry v oblastech s vysokým obsahem rozložené rostlinné hmoty..

To vede k intenzivnímu spalování biomasy v období sucha..
Tyto události jsou zdrojem vysokých koncentrací HCN v troposféře, které jsou nakonec transportovány do spodní stratosféry a zůstávají po velmi dlouhou dobu..
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- NÁS. Národní lékařská knihovna. (2019). Kyanovodík. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Gidlow, D. (2017). Kyanovodík - aktualizace. Pracovní lékařství 2017; 67: 662-663. Obnoveno z ncbi.nlm.nih.gov.
- Van Nostrandova vědecká encyklopedie. (2005). Kyanovodík. 9th Obnoveno z onlinelibrary.wiley.com.
- Ren, Y.-L. et al. (devatenáctset devadesát šest). Vliv kyanovodíku a karbonylsulfidu na klíčení a plumulární sílu pšenice. Domácí. Sci.1996, 47, 1-5. Obnoveno z onlinelibrary.wiley.com.
- Od Nicoly, G.R. et al. (2011). Jednoduchá analytická metoda pro hodnocení obsahu Dhurrinu v kyanogenních rostlinách pro jejich využití v krmivech a biofumigaci. J. Agric. Food Chem.2011, 59, 8065-8069. Obnoveno z pubs.acs.org.
- Sheese, P.E. et al. (2017). Globální vylepšení kyanovodíku v dolní stratosféře v průběhu roku 2016. Geophys. Res. Lett., 44, 5791-5797. Obnoveno z agupubs.onlinelibrary.wiley.com.
- Surleva, A.R. a Drochioiu, G. (2013). Vizualizace rizika kouření: Jednoduché spektrofotometrické stanovení kyanovodíku v cigaretovém kouři a filtrech. J. Chem. Educ.2013, 90, 1654-1657. Obnoveno z pubs.acs.org.
- Alarie, Y. a kol. (1990). Úloha kyanovodíku při lidských úmrtích při požáru. V ohni a polymerech. Kapitola 3. ACS Symposium Series. Obnoveno z pubs.acs.org.



Zatím žádné komentáře