
Struktura uhličitanu hlinitého, vlastnosti, použití

The uhličitan hlinitý je anorganická sůl, jejíž chemický vzorec je Aldva(CO.)3)3. Jedná se o prakticky neexistující uhličitan kovu, vzhledem k jeho vysoké nestabilitě za normálních podmínek..
Mezi důvody jeho nestability můžeme zmínit slabé elektrostatické interakce mezi ionty Al3+ a CO3dva-, což by teoreticky mělo být velmi silné vzhledem k velikosti jejich nábojů.
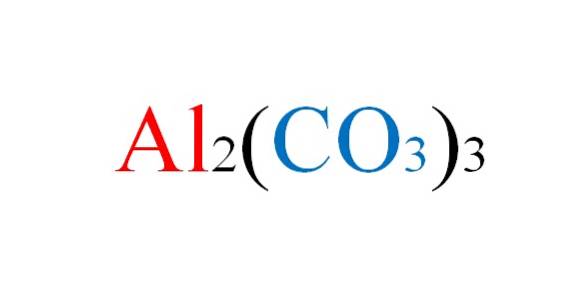
Sůl na papíře nečelí žádným nepříjemnostem, když jsou psány chemické rovnice jejích reakcí; ale v praxi se to obrací proti němu.
Navzdory tomu, co bylo řečeno, se uhličitan hlinitý může vyskytovat ve společnosti jiných iontů, jak je tomu u minerálu dawsonit. Existuje také derivát, ve kterém interaguje s vodným amoniakem. Zbytek se považuje za směs mezi Al (OH)3 a HdvaCO3; což se rovná šumivému roztoku s bílou sraženinou.
Tato směs má léčebné použití. K čisté, izolovatelné a manipulovatelné soli Aldva(CO.)3)3, žádné známé možné aplikace; alespoň ne za enormního tlaku nebo extrémních podmínek.
Rejstřík článků
- 1 Struktura uhličitanu hlinitého
- 1.1 Uhličitan amonný hydroxid hlinitý
- 2 Vlastnosti
- 2,1 molární hmotnost
- 2.2 Nestabilita
- 2.3 Fyzické
- 3 použití
- 4 Odkazy
Struktura uhličitanu hlinitého
Krystalová struktura této soli není známa, protože je tak nestabilní, že ji nelze charakterizovat. Ze svého vzorce Aldva(CO.)3)3, Je však známo, že podíl Al iontů3+ a CO3dva- je 2: 3; to znamená za každé dva Al kationtydva+ musí existovat tři anionty CO3dva- elektrostaticky s nimi interagují.
Problém je v tom, že oba ionty mají velmi nestejnou velikost; Al3+ je velmi malý, zatímco CO3dva- je to objemné. Tento rozdíl sám o sobě již ovlivňuje stabilitu mřížky krystalové mřížky, jejíž ionty by interagovaly „neohrabaně“, pokud by tato sůl mohla být izolována v pevném stavu.
Kromě tohoto aspektu Al3+ je to vysoce polarizační kation, vlastnost, která deformuje elektronický mrak CO3dva-. Je to, jako byste ho chtěli donutit kovalentně se spojit, i když to anion nemůže..
Následkem toho iontové interakce mezi Al3+ a CO3dva- inklinují ke kovalenci; další faktor, který zvyšuje nestabilitu Aldva(CO.)3)3.
Hydrogenuhličitan amonný hlinitý
Chaotický vztah mezi Al3+ a CO3dva- zjemní vzhled, jsou-li ve skle přítomny jiné ionty; jako je NH4+ a OH-, z roztoku amoniaku. Toto kvarteto iontů, Al3+, CO3dva-, NH4+ a OH-, dokážou definovat stabilní krystaly, dokonce schopné přijmout různé morfologie.
Další podobný příklad lze pozorovat u minerálu dawsonit a jeho ortorombických krystalů, NaAlCO3(ACH)dva, kde Na+ nahrazuje NH4+. V těchto solích jsou jejich iontové vazby dostatečně silné, aby voda nepodporovala uvolňování CO.dva; nebo alespoň ne náhle.
Ačkoli NH4Al (OH)dvaCO3 (AACC, pro jeho zkratku v angličtině), ani NaAlCO3(ACH)dva představují uhličitan hlinitý, lze je považovat za jejich bazické deriváty.
Vlastnosti
Molární hmotnost
233,98 g / mol.
Nestabilita
V předchozí části bylo z molekulárního hlediska vysvětleno, proč Aldva(CO.)3)3 je nestabilní. Ale jakou transformací prochází? Je třeba vzít v úvahu dvě situace: jednu suchou a druhou „mokrou“.
Suchý
V suché situaci byl anion CO3dva- vrátí se k COdva následujícím rozkladem:
Dodva(CO.)3)3 => AldvaNEBO3 + 3COdva
Což dává smysl, pokud je syntetizováno pod vysokým tlakem CO.dva; tj. obrácená reakce:
DodvaNEBO3 + 3COdva => Aldva(CO.)3)3
Proto, aby se zabránilo Aldva(CO.)3)3 sůl by měla být vystavena vysokému tlaku (s použitím Ndva, například). Tímto způsobem vznik COdva by nebylo termodynamicky zvýhodněno.
Mokré
V mokré situaci se CO3dva- podléhá hydrolýze, při které se vytváří malé množství OH-; ale dost na vysrážení hydroxidu hlinitého, Al (OH)3:
CO3dva- + HdvaNEBO <=> HCO3- + Ach-
Do3+ + 3OH- <=> Al (OH)3
A na druhé straně Al3+ také hydrolyzuje:
Do3+ + HdvaNEBO <=> Al (OH)dvadva+ + H+
Ačkoli Al by ve skutečnosti nejprve hydratoval3+ za vzniku komplexu Al (HdvaNEBO)63+, který se hydrolyzuje za vzniku [Al (HdvaNEBO)5ACH]dva+ a H3NEBO+. Pak H3O (nebo H+) proton na CO3dva- do HdvaCO3, který se rozkládá na COdva a HdvaNEBO:
CO3dva- + 2H+ => HdvaCO3
HdvaCO3 <=> COdva + HdvaNEBO
Všimněte si, že nakonec Al3+ chová se jako kyselina (uvolňuje H+) a báze (uvolňuje OH- s bilancí rozpustnosti Al (OH)3); to znamená, že vykazuje amfotericismus.
Fyzický
Pokud ji lze izolovat, je pravděpodobné, že tato sůl bude mít bílou barvu, stejně jako mnoho jiných solí hliníku. Také kvůli rozdílu mezi iontovými poloměry Al3+ a CO3dva-, určitě by měl velmi nízké teploty tání nebo varu ve srovnání s jinými iontovými sloučeninami.
A pokud jde o jeho rozpustnost, byl by nekonečně rozpustný ve vodě. Dále by to byla hygroskopická a křehká pevná látka. Jedná se však pouze o dohady. U počítačových modelů vystavených vysokým tlakům by bylo nutné odhadnout další vlastnosti..
Aplikace
Známé aplikace uhličitanu hlinitého jsou lékařské. Používal se jako mírný stahující prostředek a jako lék k léčbě žaludečních vředů a zánětů. Používá se také k prevenci tvorby močových kamenů u lidí..
Používá se ke kontrole zvýšení obsahu fosfátů v těle a také k léčbě příznaků pálení žáhy, kyselých zažívacích potíží a žaludečních vředů..
Reference
- XueHui L., Zhe T., YongMing C., RuiYu Z. & Chenguang L. (2012). Hydrotermální syntéza nanoplatelet a nanovláken s hydrofobičitanem amonným hydroxidem hlinitým (AACH) pH řízené morfologie. Atlantis Press.
- Robin Lafficher, Mathieu Digne, Fabien Salvatori, Malika Boualleg, Didier Colson, Francois Puel (2017) Hydroxid uhličitanu amonno-hlinitého NH4Al (OH) 2CO3 jako alternativní cesta pro přípravu oxidu hlinitého: srovnání s klasickým prekurzorem boehmitu. Powder Technology, 320, 565-573, DOI: 10.1016 / j.powtec.2017.07.0080
- Národní centrum pro biotechnologické informace. (2019). Uhličitan hlinitý. PubChem Database., CID = 10353966. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2019). Uhličitan hlinitý. Obnoveno z: en.wikipedia.org
- Síran hlinitý. (2019). Uhličitan hlinitý. Obnoveno z: aluminiumsulfate.net


Zatím žádné komentáře