
CHON společné charakteristiky, zvláštnosti a molekuly
CHON: C uhlík, H vodík, O kyslík a N dusík, jsou skupina chemických prvků, které tvoří živou hmotu. Díky svému umístění v periodické tabulce sdílejí tyto atomy vlastnosti, díky nimž jsou vhodné pro tvorbu organických a kovalentních molekul..
Tyto čtyři chemické prvky tvoří většinu molekul živých bytostí, které se nazývají bioelementy nebo biogenní prvky. Patří do skupiny primárních nebo hlavních bioelementů, protože jsou 95% v molekulách živých bytostí.
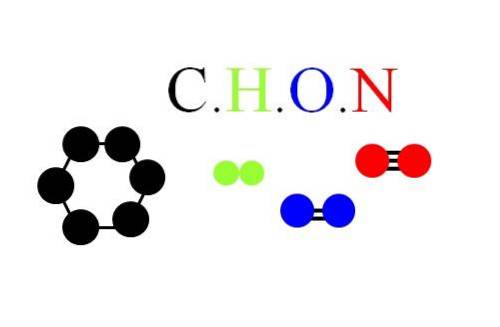
Molekuly a atomy CHON jsou zobrazeny na horním obrázku: šestiúhelníkový kruh jako molekulární jednotka v uhlíku; molekula H.dva (Zelená barva); rozsivková molekula Odva (barva modrá); a rozsivková molekula Ndva (zbarvená červeně) s trojitou vazbou.
Kromě společných vlastností mají některé zvláštnosti nebo vlastnosti, které vysvětlují, proč jsou vhodné pro tvorbu biomolekul. Díky nízké atomové hmotnosti nebo hmotnosti je činí velmi elektronegativními a vytvářejí stabilní, silné a vysokoenergetické kovalentní vazby..
Spojují se dohromady a tvoří součást struktury organických biomolekul, jako jsou proteiny, sacharidy, lipidy a nukleové kyseliny. Podílejí se také na tvorbě anorganických molekul nezbytných pro život; jako je voda, HdvaNEBO.
Rejstřík článků
- 1 Společné rysy CHON
- 1.1 Nízká atomová hmotnost
- 1.2 Vysoká elektronegativita
- 2 Speciální funkce
- 2.1 Atom uhlíku C
- 2.2 Atom H
- 2.3 Atom O
- 2.4 Atom dusíku
- 3 molekuly, které tvoří CHON
- 3,1 vody
- 3.2 Plyny
- 3.3 Biomolekuly
- 4 Odkazy
CHON Společné funkce
Nízká atomová hmotnost
Mají nízkou atomovou hmotnost. Atomové hmotnosti C, H, O a N jsou: 12u, 1u, 16u a 14u. To způsobí, že mají menší poloměr atomu, což jim zase umožňuje vytvořit stabilní a silné kovalentní vazby..
Kovalentní vazby se tvoří, když atomy, které se podílejí na tvorbě molekul, sdílejí své valenční elektrony..
Díky nízké atomové hmotnosti, a tedy i nižšímu poloměru atomu, jsou tyto atomy velmi elektronegativní.
Vysoká elektronegativita
C, H, O a N jsou velmi elektronegativní: silně přitahují sdílené elektrony, když vytvářejí vazby v molekule.
Všechny společné vlastnosti popsané pro tyto chemické prvky jsou příznivé pro stabilitu a pevnost kovalentních vazeb, které tvoří..
Kovalentní vazby, které tvoří, mohou být nepolární, když se spojí stejné prvky a tvoří diatomické molekuly, jako je Odva. Mohou být také polární (nebo relativně polární), když je jeden z atomů více elektronegativní než druhý, jako v případě O vzhledem k H.
Tyto chemické prvky mají pohyb mezi živými bytostmi a prostředím známý jako biogeochemický cyklus v přírodě..
Speciální funkce
Níže jsou uvedeny některé zvláštnosti nebo vlastnosti, které každý z těchto chemických prvků vlastní, což je důvodem pro jeho strukturální funkci biomolekul.
Atom uhlíku C
-Díky své tetravalenci může C tvořit 4 vazby se 4 různými nebo stejnými prvky, které tvoří širokou škálu organických molekul.
-Může být připojen k dalším atomům uhlíku, které tvoří dlouhé řetězce, které mohou být lineární nebo rozvětvené.
-Může také tvořit cyklické nebo uzavřené molekuly.
-Může tvořit molekuly s jednoduchými, dvojitými nebo trojitými vazbami. Pokud ve struktuře kromě C existuje čistý H, hovoříme o uhlovodících: alkany, alkeny a alkiny.
-Spojením s O nebo N získá vazba polaritu, která usnadňuje rozpustnost molekul, z nichž pochází..
-V kombinaci s jinými atomy, jako jsou O, H a N, tvoří různé rodiny organických molekul. Může tvořit aldehydy, ketony, alkoholy, karboxylové kyseliny, aminy, ethery, estery a další sloučeniny.
-Organické molekuly budou mít různou prostorovou konformaci, která bude souviset s funkčností nebo biologickou aktivitou..
Atom H
-Má nejnižší atomové číslo ze všech chemických prvků a kombinuje se s O za vzniku vody.
-Tento atom H je ve velké části přítomen v uhlíkových kostrách, které tvoří organické molekuly..
-Čím větší je počet C-H vazeb v biomolekulách, tím větší je energie produkovaná jejich oxidací. Z tohoto důvodu oxidace mastných kyselin generuje více energie než energie produkovaná při katabolismu sacharidů..
O atom
Je to bioelement, který společně s H tvoří vodu. Kyslík je více elektronegativní než vodík, což mu umožňuje vytvářet dipoly v molekule vody..
Tyto dipóly usnadňují tvorbu silných interakcí, které se nazývají vodíkové vazby. Slabé vazby, jako jsou H můstky, jsou nezbytné pro molekulární rozpustnost a pro udržení struktury biomolekul..
Atom dusíku
-Nachází se v aminoskupině aminokyselin a ve variabilní skupině některých aminokyselin, jako je například histidin.
-Je nezbytný pro tvorbu amino cukrů, dusíkatých bází nukleotidů, koenzymů, mimo jiné organických molekul.
Molekuly, které tvoří CHON
Voda

H a O jsou spojeny kovalentními vazbami, tvořící vodu v poměru 2H a O. Protože kyslík je více elektronegativní než vodík, spojují se a tvoří kovalentní vazbu polárního typu..
Tím, že má tento typ kovalentní vazby, umožňuje rozpustit mnoho látek tím, že s nimi vytváří vodíkové vazby. Voda je součástí struktury organismu nebo živé bytosti v přibližně 70 až 80%.
Voda je univerzální rozpouštědlo, plní mnoho funkcí v přírodě i v živých bytostech; má strukturální, metabolické a regulační funkce. Ve vodném prostředí se kromě mnoha dalších funkcí provádí většina chemických reakcí živých bytostí..
Plyny

Spojením apolárního kovalentního typu, tj. Bez rozdílu elektronegativity, jsou spojeny stejné atomy, jako je O. Vznikají tak atmosférické plyny, jako je dusík a molekulární kyslík, nezbytné pro životní prostředí a živé bytosti..
Biomolekuly

Tyto bioelementy se spojují navzájem a s dalšími bioelementy a tvoří molekuly živých bytostí.
Jsou spojeny kovalentními vazbami, čímž vznikají monomerní jednotky nebo jednoduché organické molekuly. Ty jsou zase spojeny kovalentními vazbami a tvoří polymery nebo složité organické molekuly a supramolekuly..
Aminokyseliny tedy tvoří bílkoviny a monosacharidy jsou strukturálními jednotkami sacharidů nebo sacharidů. Mastné kyseliny a glycerol tvoří zmýdelnitelné lipidy a mononukleotidy nukleové kyseliny DNA a RNA.
Mezi supramolekuly patří například: glykolipidy, fosfolipidy, glykoproteiny, lipoproteiny, mimo jiné.
Reference
- Carey F. (2006). Organická chemie. (6. vydání). Mexiko, Mc Graw Hill.
- Hrdina kurzu. (2018). 2 funkce bio prvků bioelementů primární mezi. Obnoveno z: coursehero.com
- Cronodon. (s.f.). Bioelementy. Obnoveno z: cronodon.com
- Životní osoba. (2018). Bioelementy: Klasifikace (primární a sekundární). Obnoveno z: lifepersona.com
- Mathews, Holde a Ahern. (2002). Biochemistry (3. vyd.). Madrid: PEARSON


Zatím žádné komentáře