
Co je energetický diagram? (s příklady)

A energetický diagram je energetický graf, který ilustruje proces, který probíhá během reakce. Energetické diagramy lze také definovat jako vizualizaci elektronové konfigurace na orbitálech; každá reprezentace je elektron z orbitálu se šipkou.
Například v energetickém diagramu šipky směřující nahoru představují elektron s kladnou rotací. Šipky směřující dolů jsou zase zodpovědné za reprezentaci elektronu se zápornou rotací.
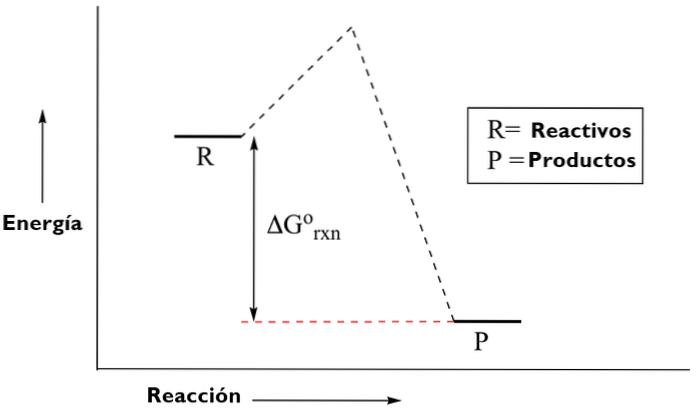
Existují dva typy energetických diagramů. Diagramy termodynamiky nebo organické chemie, které ukazují množství energie generované nebo vynaložené v průběhu reakce; počínaje prvky, které jsou reaktivní, procházejí přechodovým stavem, k produktům.
A diagramy anorganické chemie, které slouží k demonstraci molekulárních orbitalů podle energetické úrovně atomů.
Druhy energetických diagramů
Termodynamické diagramy
Termodynamické diagramy jsou diagramy používané k reprezentaci termodynamických stavů hmoty (obvykle tekutin) a důsledků manipulace s tímto materiálem.
Například entropický teplotní diagram lze použít k demonstraci chování tekutiny, jak se mění prostřednictvím kompresoru..
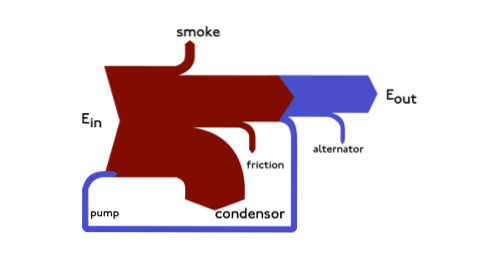
Sankeyho diagramy jsou energetické diagramy, ve kterých je tloušťka šipek zobrazena úměrně k množství toku. Příklad lze ilustrovat takto:
Tento diagram představuje celý primární tok energie v továrně. Tloušťka pásů je přímo úměrná energii výroby, použití a ztrátám.
Primárními zdroji energie jsou plyn, elektřina a uhlí / ropa a představují energetický vstup na levé straně diagramu..
Můžete také zobrazit výdaje na energii, tok materiálu na regionální nebo národní úrovni a rozpis nákladů na položku nebo služby..
Tyto diagramy kladou vizuální důraz na velké přenosy energie nebo toky v systému..
A jsou velmi užitečné při hledání dominantních příspěvků v obecném toku. Tyto diagramy často ukazují konzervované veličiny v mezích definovaného systému..
P-V diagram
Používá se k popisu změn odpovídajících měření objemu a tlaku v systému. Obvykle se používají v termodynamice, kardiovaskulární fyziologii a fyziologii dýchání..
P-V diagramy se původně nazývaly indikátorové diagramy. Byly vyvinuty v 18. století jako nástroje k pochopení účinnosti parních strojů..
Diagram P-V ukazuje změnu tlaku P vzhledem k objemu V u některého procesu nebo procesů.
V termodynamice tyto procesy tvoří cyklus, takže po dokončení cyklu nedojde ke změně stavu systému; jako například v přístroji, který se vrátí na původní tlak a objem.
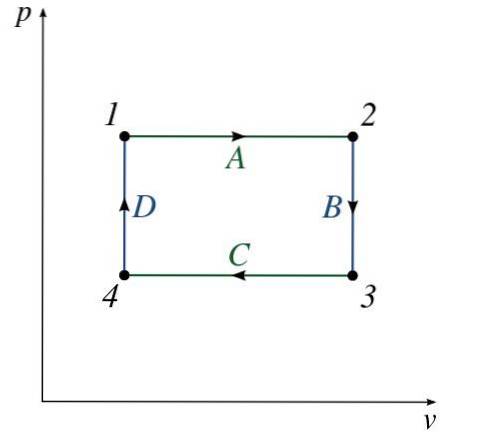
Obrázek ukazuje vlastnosti typického P-V diagramu. Lze pozorovat řadu očíslovaných stavů (od 1 do 4).
Cesta mezi jednotlivými stavy se skládá z nějakého procesu (A až D), který mění tlak nebo objem systému (NEBO oba).
T-S diagram
Používá se v termodynamice k vizualizaci změn teploty a specifické entropie během termodynamického procesu nebo cyklu..
Je to velmi užitečný a velmi běžný nástroj v této oblasti, zejména proto, že pomáhá vizualizovat přenos tepla během procesu..
U reverzibilních nebo ideálních procesů je oblastí pod křivkou TS procesu teplo přenášené do systému během tohoto procesu..
Isentropický proces je grafován jako svislá čára na T-S diagramu, zatímco izotermický proces je zobrazen jako vodorovná čára..
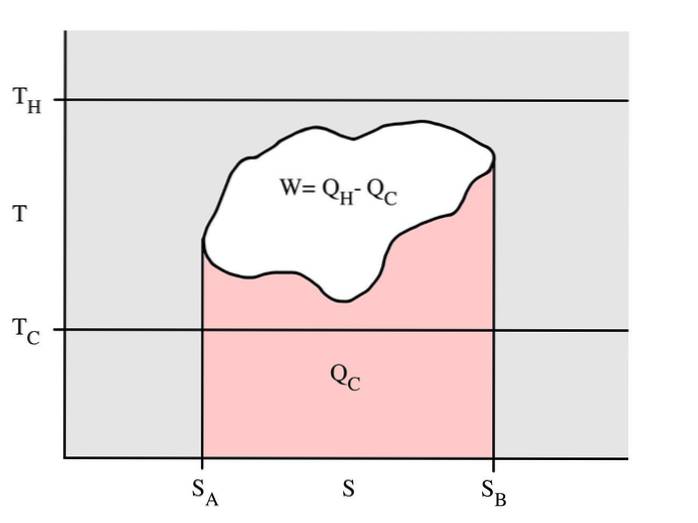
Tento příklad ukazuje termodynamický cyklus, který probíhá při teplotě Tc horké nádrže a teplotě Tc studené nádrže. V reverzibilním procesu je červená oblast Qc množství energie vyměněné mezi systémem a studeným zásobníkem.
Prázdná oblast W je množství energie vyměněné mezi systémem a jeho okolím. Množství tepla Qh vyměňovaného mezi horkou nádrží je součtem těchto dvou.
Pokud se cyklus posune doprava, znamená to, že jde o tepelný motor, který uvolňuje práci. Pokud se cyklus pohybuje v opačném směru, jedná se o tepelné čerpadlo, které přijímá práci a přenáší teplo Qh ze studené nádrže do horké nádrže.
Schémata anorganické chemie
Slouží k reprezentaci nebo schematizaci molekulárních orbitalů souvisejících s atomy a jejich energetické úrovni.
Schéma potenciální energie etanu
Různé konformace etanu nebudou mít stejnou energii, protože mají odlišný elektronický odpor mezi vodíky.
Jak se molekula otáčí, počínaje již rozloženou konformací, vzdálenost mezi atomy vodíku konkrétních methylových skupin se začíná zmenšovat. Potenciální energie tohoto systému bude narůstat, dokud nedosáhne zatmění konformace.
Různé typy energie mezi různými konformacemi lze graficky znázornit. V etanovém diagramu je pozorováno, jak jsou zatměné konformace maximální energií; na druhé straně by alternativy byly minimální.
V tomto diagramu potenciální energie vychází ethan ze zatměné konformace. Poté se otáčí od 60 ° do 60 °, dokud není 360 ° zakryto.
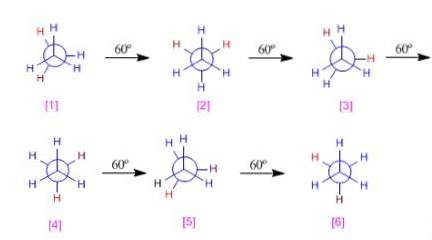
Různé konformace lze klasifikovat podle energie. Například alternátory 1,3 a 5 mají stejnou energii (0). Na druhou stranu konformace 2,4 a 6 budou mít více energie v důsledku zatmění vodík-vodík
Reference
- Diagram objemového tlaku. Obnoveno z wikipedia.org
- T-S diagram. Obnoveno z wikipedia.org
- Sankey diagram. Obnoveno z wikipedia.org
- Diagramy potenciální energie. (2009). Obnoveno z quimicaorganica.net


Zatím žádné komentáře