
Struktura, vlastnosti, rizika, použití kyanidu sodného (NaCN)

The Kyanid sodný je anorganická sůl tvořená sodným kationtem Na+ a kyanidový anion CN-. Jeho chemický vzorec je NaCN. Také známý jako kyanid sodný, je to bílá krystalická pevná látka. Je hygroskopický, to znamená, že absorbuje vodu z prostředí a jeho krystaly jsou krychlové jako chlorid sodný NaCl.
Po rozpuštění ve vodě má sklon k tvorbě kyanovodíku HCN. Jeho řešení snadno rozpouští zlato a stříbro. Díky této vlastnosti se používá k těžbě zlata a stříbra z minerálů. Řešení použitá k tomuto účelu jsou recyklována, to znamená, že jsou několikrát znovu použita.

Některým z kyanidů se však podaří uniknout do určitých odpadních rybníků, což představuje nebezpečí pro divokou zvěř i pro lidi, protože kyanid je velmi toxický a může způsobit smrt..
NaCN se používá v chemickém průmyslu jako meziprodukt k přípravě různých typů sloučenin, jako jsou barviva, zemědělské chemikálie a léky nebo léky..
Kyanid sodný je velmi nebezpečná sloučenina, protože může způsobit smrt, a proto s ní musí být zacházeno s maximální opatrností.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Hustota
- 3.7 Rozpustnost
- 3.8 Disociační konstanta
- 3,9 pH
- 3.10 Chemické vlastnosti
- 4 Rizika
- 5 Získání
- 6 použití
- 6.1 Při těžbě zlatých a stříbrných minerálů. Důsledky
- 6.2 Při výrobě dalších chemických sloučenin
- 6.3 V kovoprůmyslu
- 6.4 V jiných použitích
- 6.5 Nepoužívané, dotazované nebo velmi vzácné aplikace
- 7 Reference
Struktura
Kyanid sodný se skládá z iontu Na + a iontu CN-.
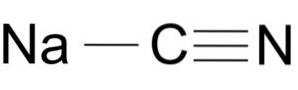
Kyanidový iont má atom uhlíku C a atom dusíku N navzájem spojené trojnou vazbou..
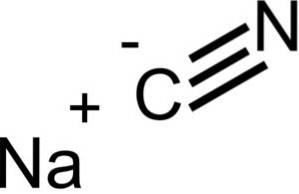
NaCN má stejnou krystalickou strukturu jako NaCl, takže jeho krystaly jsou krychlové.
Nomenklatura
-Kyanid sodný
-Kyanid sodný
Vlastnosti
Fyzický stav
Hygroskopická bílá krystalická pevná látka (absorbuje vodu z prostředí).
Molekulární váha
49,007 g / mol
Bod tání
563,7 ° C
Bod varu
1496 ° C
Bod vzplanutí
Není hořlavý. Pokud je však vystaven ohni, vzniká kyanovodík HCN a oxidy dusíku..
Hustota
1595 g / cm3 při 20 ° C
Rozpustnost
Velmi dobře rozpustný ve vodě: 48 g / 100 ml při 10 ° C, 82 g / 100 ml při 35 ° C. Mírně rozpustný v alkoholu
Disociační konstanta
Hydrolyzuje se ve vodném roztoku za vzniku kyanovodíku HCN. Konstanta této hydrolýzy je K.h = 2,5 x 10-5.
pH
Vodné roztoky NaCN jsou silně zásadité
Chemické vlastnosti
Po rozpuštění ve vodě se rozdělí na své ionty Na+ a CN-. Ve vodném roztoku kyanidový ion CN- vezměte proton H+ vody HdvaNebo tvoří HCN a OH iont-, takže roztok zalkalizuje.
CN- + HdvaO → HCN + OH-
Z tohoto důvodu se jeho vodné roztoky při skladování rychle rozkládají a tvoří kyanovodík HCN..
Je korozivní vůči hliníku. Jeho řešení snadno rozpouští zlato Au a stříbro Ag za přítomnosti vzduchu..
Je to chelatační činidlo, protože kyanidový anion CN- snadno se váže na jiné kovy, jako je stříbro, zlato, rtuť, zinek, kadmium atd..
Má slabý hořký mandlový zápach.
Rizika
Musí s ním být zacházeno velmi opatrně. Je to vysoce jedovatá sloučenina, inhibuje důležité metabolické procesy a vede ke smrti požitím, vdechnutím, absorpcí kůží nebo kontaktem s očima..
Při vdechování se NaCN rozpouští ve sliznici dýchacích cest a přechází do krevního řečiště. Kyanidový ion NaCN má silnou afinitu k železu v oxidačním stavu +3, tj. Železitý kation Fe3+.
Když je kyanid absorbován, reaguje rychle s Fe3+ důležitého enzymu mitochondrií buněk (cytochromoxidáza), zabraňující určitým procesům dýchání tohoto.
Proto je buněčné dýchání inhibováno nebo zpomaleno a dochází k cytotoxické hypoxii. To znamená, že buňky a tkáně nejsou schopny využívat kyslík, zejména mozkové a srdeční buňky.
Tímto způsobem dochází k trvalému nebo smrtelnému poškození těla. K tomu může dojít u lidí i zvířat..
Při požití kromě výše uvedených způsobí přetížení cév a korozi žaludeční sliznice..

Není hořlavý, ale při kontaktu s kyselinami uvolňuje HCN, který je vysoce hořlavý a toxický.
Pokud se roztaví s dusitany nebo chlorečnany, může explodovat.
Získávání
Lze získat sodíkem sodným, amoniakem NH3 a uhlík C. Sodík reaguje s amoniakem za vzniku amidu sodného NaNHdva:
2 Na + 2 NH3 → 2 NaNHdva + Hdva↑
Amid sodný se zahřívá uhlím na 600 ° C a produkuje kyanamid sodný NadvaNCN, který se poté při 800 ° C převede na kyanid sodný s aktivním uhlím:
2 NaNHdva + C → 2 Hdva↑ + NadvaNCN
NadvaNCN + C → 2 NaCN
Další metodou je roztavení kyanamidu vápenatého CaNCN a uhlíku C s uhličitanem sodným NadvaCO3:
CaNCN + C + NadvaCO3 → CaCO3 + 2 NaCN
Může být také připraven průchodem plynného dusíku Ndva horkou směsí uhličitanu sodného NadvaCO3 a práškový uhlík C s použitím železa Fe jako katalyzátoru nebo urychlovače reakce:
NadvaCO3 + 4 C + Ndva → 2 NaCN + 3 CO ↑
Aplikace
Při těžbě zlatých a stříbrných minerálů. Důsledky
Kyanid sodný se již dlouho používá k extrakci kovů, zlata a stříbra z jejich rud..
Kyanid použitý v tomto procesu se recykluje, ale něco unikne do odpadního jezírka spolu s neobnovenými těžkými kovy.
Ptáci, netopýři a další zvířata, kteří pijí z těchto lakyň s kyanidem, byli otráveni.
Existují záznamy o přehradě v Rumunsku, která izolovala odpadní jezírko a byla poškozena povětrnostními událostmi..
V důsledku toho byly do řeky Sasar a blízkých vodonosných systémů, jako jsou řeky Lapus, Somes a Tisa, vypuštěny tuny kyanidu, které končí v Dunaji..
To způsobilo kaskádu úmrtí zvířat, nebo jinými slovy ekologickou katastrofu..

Při výrobě dalších chemických sloučenin
NaCN kyanid sodný se používá při syntéze různých typů organických sloučenin.
Připravují se například pigmenty a barviva (včetně optických zjasňovačů), sloučeniny pro použití v zemědělství nebo agrochemikálie a různá farmaceutika..
Používá se také k získání chelatačních nebo sekvestračních činidel pro ionty kovů..
Sloučeniny zvané nitrily se připravují s kyanidem sodným NaCN, který při zpracování horkým kyselým nebo alkalickým vodným roztokem umožňuje získat karboxylové kyseliny.
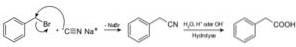
Umožňuje přípravu mastných kyselin s kyanoskupinami, kyanidy těžkých kovů a kyselinou kyanovodíkovou nebo HCN kyanovodík.
V kovoprůmyslu
NaCN se používá v roztocích používaných při galvanickém pokovování nebo galvanickém pokovování kovů (potahování kovů jinými), například zinku.
Je to součást kalené oceli. Slouží také k čištění kovů.
V jiných použitích
Kyanid sodný je meziproduktem při výrobě nylonu.
Slouží k oddělení minerálů plovoucí flotací.
Aplikace mimo provoz, zpochybňované nebo velmi vzácné
NaCN byl použit k zabíjení hlodavců, jako jsou králíci a krysy, a jejich nor, a k zabíjení hnízd termitů.
V současné době se příležitostně používá k eliminaci kojotů, lišek a divokých psů. Používá se ve formě tobolek jako jedna nebo více dávek na pastvinách, lovištích a lesích.
Kvůli extrémní toxicitě by NaCN měli používat pouze vyškolení jednotlivci..
Toto použití je považováno za velmi nebezpečné pro člověka, ale existují lidé, kteří jej stále používají.

V zemědělství se dříve používal k fumigaci stromů citrusových plodů a jiného ovoce. Používal se také jako insekticid a miticid (odstraňovač roztočů), které se mají aplikovat po sklizni, na neskladované citrusové plody nebo na fumigaci nákladních vozidel používaných k jejich přepravě. To bylo také používáno k fumigaci lodí, železničních vozů a skladů..
Všechna tato použití byla zpochybněna kvůli vysoké toxicitě kyanidu sodného. Z tohoto důvodu se již nepoužívá nebo jen velmi zřídka a za velmi kontrolovaných podmínek..
Reference
- NÁS. Národní lékařská knihovna. (2019). Kyanid sodný. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Čtvrté vydání. John Wiley & Sons.
- Hurst, HE a Martin, M.D. (2017). Toxikologie. Kyanid. In Pharmacology and Therapeutics for Dentistry (Sedmé vydání). Obnoveno ze sciencedirect.com.
- Coppock, R.W. a Dziwenka, M. (2015). Hrozby pro divokou zvěř agenty chemické války. In Handbook of Toxicology of Chemical Warfare Agents (Second Edition). Obnoveno ze sciencedirect.com.
- Morrison, R.T. a Boyd, R.N. (2002). Organická chemie. 6. vydání. Prentice-Hall.


Zatím žádné komentáře