
Vlastnosti a typy meziatomových vazeb

The odkaz interatomové Jedná se o chemickou vazbu, která se vytváří mezi atomy za vzniku molekul. Ačkoli se dnes vědci obecně shodují na tom, že elektrony se netočí kolem jádra, v průběhu historie se předpokládalo, že každý elektron obíhá kolem jádra atomu v samostatné skořápce..
Vědci dnes dospěli k závěru, že elektrony se vznášejí nad určitými oblastmi atomu a netvoří oběžné dráhy, přesto se valenční obal používá k popisu dostupnosti elektronů..
Linus Pauling přispěl k modernímu chápání chemických vazeb tím, že napsal knihu „The Nature of Chemical Bonding“, kde sbíral nápady od sira Isaaca Newtona, Étienne François Geoffroy, Edwarda Franklanda a zejména Gilberta N. Lewise.
V něm spojil fyziku kvantové mechaniky s chemickou povahou elektronických interakcí, ke kterým dochází při vytváření chemických vazeb..
Paulingova práce se zaměřila na zjištění, že skutečné iontové vazby a kovalentní vazby leží na koncích spektra vazeb a že většina chemických vazeb je klasifikována mezi těmito extrémy..
Pauling dále vyvinul posuvnou stupnici typu vazby řízenou elektronegativitou atomů zapojených do vazby..
Paulingovy nesmírné příspěvky k našemu modernímu chápání chemických vazeb vedly k tomu, že mu byla v roce 1954 udělena Nobelova cena za „vyšetřování povahy chemických vazeb a jejich použití k objasnění struktury složitých látek“.
Živé věci jsou tvořeny atomy, ale ve většině případů tyto atomy neplují jen jednotlivě. Místo toho normálně interagují s jinými atomy (nebo skupinami atomů).
Atomy mohou být například spojeny silnými vazbami a uspořádány do molekul nebo krystalů. Nebo mohou vytvářet dočasné slabé vazby s jinými atomy, které se s nimi střetávají..
Silné vazby, které váží molekuly, a slabé vazby, které vytvářejí dočasná spojení, jsou nezbytné pro chemii našich těl a pro existenci samotného života..
Atomy mají tendenci uspořádat se v co nejstabilnějších vzorcích, což znamená, že mají tendenci dokončovat nebo vyplňovat své nejvzdálenější elektronové dráhy..
Navazují vazby na jiné atomy. Síla, která drží atomy pohromadě ve sbírkách známých jako molekuly, se nazývá chemická vazba..
Druhy interatomových chemických vazeb
Kovová vazba
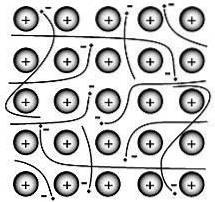
Kovová vazba je síla, která drží atomy pohromadě v čisté kovové látce. Taková pevná látka se skládá z těsně zabalených atomů.
Ve většině případů se vnější elektronový obal každého z atomů kovu překrývá s velkým počtem sousedních atomů. V důsledku toho se valenční elektrony neustále pohybují od atomu k atomu a nejsou spojeny se žádným konkrétním párem atomů..
Kovy mají několik vlastností, které jsou jedinečné, například schopnost vést elektřinu, nízká ionizační energie a nízká elektronegativita (takže se snadno vzdávají elektronů, tj. Jsou to kationty)..
Jejich fyzikální vlastnosti zahrnují lesklý (lesklý) vzhled a jsou tvárné a tvárné. Kovy mají krystalickou strukturu. Kovy jsou však také tvárné a tvárné.
V 20. letech 20. století přišel Paul Drüde s teorií elektronových moří modelováním kovů jako směsi atomových jader (atomová jádra = pozitivní jádra + vnitřní elektronový obal) a valenčních elektronů..
V tomto modelu jsou valenční elektrony volné, delokalizované, mobilní a nejsou spojeny s žádným konkrétním atomem..
Iontová vazba
Iontové vazby jsou elektrostatické povahy. Vyskytují se, když se prvek s kladným nábojem spojí s negativním nábojem coulombickými interakcemi.
Prvky s nízkou ionizační energií mají tendenci snadno ztrácet elektrony, zatímco prvky s vysokou afinitou k elektronům mají tendenci získávat je produkující kationty a anionty, které vytvářejí iontové vazby..
Sloučeniny vykazující iontové vazby vytvářejí iontové krystaly, ve kterých kladné a záporně nabité ionty oscilují blízko sebe, ale ne vždy existuje přímá korelace 1-1 mezi kladnými a zápornými ionty..
Iontové vazby lze typicky rozbít hydrogenací nebo přidáním vody ke sloučenině.
Látky držené pohromadě iontovými vazbami (jako je chlorid sodný) se mohou běžně oddělit na skutečně nabité ionty, když na ně působí vnější síla, například když se rozpustí ve vodě..
Kromě toho v pevné formě nejsou jednotlivé atomy přitahovány k individuálnímu sousedovi, ale místo toho tvoří obří sítě, které jsou navzájem přitahovány elektrostatickými interakcemi mezi jádrem každého atomu a sousedními valenčními elektrony..
Síla přitažlivosti mezi sousedními atomy dává iontovým pevným látkám extrémně uspořádanou strukturu známou jako iontová mřížka, kde se opačně nabité částice navzájem srovnávají a vytvářejí pevně vázanou tuhou strukturu..

Kovalentní vazba
Kovalentní vazba nastává, když jsou páry elektronů sdíleny atomy. Atomy se kovalentně spojí s jinými atomy, aby získaly větší stabilitu, která se získá vytvořením úplného elektronového obalu.
Sdílením svých nejvzdálenějších (valenčních) elektronů mohou atomy naplnit svůj vnější obal elektrony a získat stabilitu..
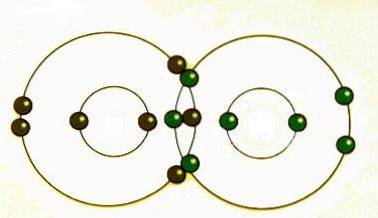
Ačkoli se říká, že atomy sdílejí elektrony, když tvoří kovalentní vazby, často nesdílejí elektrony stejně. Pouze když dva atomy stejného prvku tvoří kovalentní vazbu, jsou sdílené elektrony ve skutečnosti sdíleny rovnoměrně mezi atomy..
Když atomy různých prvků sdílejí elektrony prostřednictvím kovalentní vazby, elektron bude tažen dále směrem k atomu s nejvyšší elektronegativitou, což povede k polární kovalentní vazbě..
Ve srovnání s iontovými sloučeninami mají kovalentní sloučeniny obvykle nižší teplotu tání a teplotu varu a je méně pravděpodobné, že se rozpustí ve vodě..
Kovalentní sloučeniny mohou být v plynném, kapalném nebo pevném stavu a nevedou dobře elektřinu ani teplo..
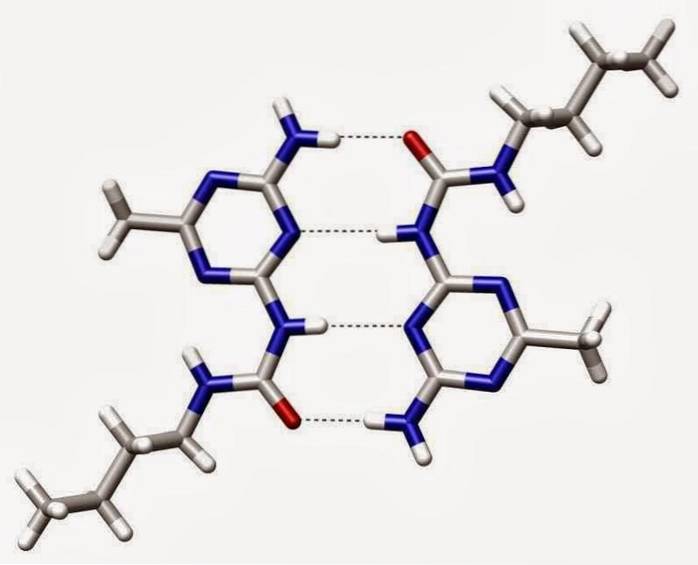
Vodíkové vazby
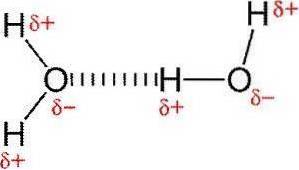
Vodíkové vazby nebo vodíkové vazby jsou slabé interakce mezi atomem vodíku připojeným k elektronegativnímu prvku s jiným elektronegativním prvkem.
V polární kovalentní vazbě, která obsahuje vodík (například vazba O-H v molekule vody), bude mít vodík mírný kladný náboj, protože vazebné elektrony jsou silněji přitahovány k druhému prvku..
Díky tomuto mírnému kladnému náboji bude vodík přitahován ke všem sousedním záporným nábojům..
Odkazy na Van der Waals
Jsou to relativně slabé elektrické síly, které navzájem přitahují neutrální molekuly v plynech, v zkapalněných a ztuhlých plynech a téměř ve všech organických a pevných kapalinách..
Síly jsou pojmenovány podle nizozemského fyzika Johannesa Diderika van der Waalsa, který v roce 1873 nejprve postuloval tyto mezimolekulární síly při vývoji teorie vysvětlující vlastnosti skutečných plynů..
Van der Waalsovy síly je obecný termín používaný k definování přitažlivosti mezimolekulárních sil mezi molekulami..
Existují dvě třídy Van der Waalsových sil: londýnské disperzní síly, které jsou slabé a silnější dipól-dipólové síly..
Reference
- Anthony Capri, A. D. (2003). Chemická vazba: povaha chemické vazby. Obnoveno z visionlearning visionlearning.com
- Camy Fung, N. M. (2015, 11. srpna). Kovalentní vazby. Převzato z chem.libretexts chem.libretexts.org
- Clark, J. (2017, 25. února). Kovové lepení. Převzato z chem.libretexts chem.libretexts.org
- Encyklopedie Britannica. (2016, 4. dubna). Kovová vazba. Převzato z britannica britannica.com.
- Encyklopedie Britannica. (2016, 16. března). Van der Waalsovy síly. Převzato z britannica britannica.com
- Kathryn Rashe, L. P. (2017, 11. března). Van der Waalsovy síly. Převzato z chem.libretexts chem.libretexts.org.
- Khan, S. (S.F.). Chemické vazby. Převzato z khanacademy khanacademy.org.
- Martinez, E. (2017, 24. dubna). Co je Atomic Bonding? Převzato ze sciencing sciencing.com.
- Wyzant, Inc. (S.F.). Vazby. Převzato z wyzant wyzant.com.



Zatím žádné komentáře