
Historie, struktura, vlastnosti, použití kyseliny octové
The octová kyselina nebo kyselina ethanová je bezbarvá organická kapalina, jejíž chemický vzorec je CH3COOH. Po rozpuštění ve vodě se získá známá směs zvaná ocet, která se již dlouho používá jako přísada do potravin. Ocet je vodný roztok kyseliny octové o koncentraci přibližně 5%.
Jak název napovídá, jedná se o kyselou sloučeninu, a proto má ocet hodnoty pH nižší než 7. V přítomnosti své octové soli tvoří pufrovací systém, který je účinný při regulaci pH mezi 2,76 a 6,76; to znamená, že udržuje pH v tomto rozmezí mírným přidáváním báze nebo kyseliny.

Jeho vzorec stačí k tomu, aby si uvědomil, že je tvořen spojením methylové skupiny (CH3) a karboxylová skupina (COOH). Po kyselině mravenčí, HCOOH, je jednou z nejjednodušších organických kyselin; což také představuje koncový bod mnoha fermentačních procesů.
Kyselinu octovou lze tedy vyrábět aerobní a anaerobní bakteriální fermentací a chemickou syntézou, přičemž hlavním mechanismem její výroby je proces karbonylace methanolu..
Kromě každodenního použití jako zálivka, v průmyslu, představuje surovinu pro výrobu acetátu celulózy, polymeru, který se používá k výrobě fotografických filmů. Kyselina octová se navíc používá při syntéze polyvinylacetátu, který se používá k výrobě lepidla na dřevo..
Když se ocet stane vysoce koncentrovaným, již se tak nenazývá a nazývá se ledová kyselina octová. Při těchto koncentracích, i když je to slabá kyselina, je vysoce žíravý a může způsobit podráždění kůže a dýchání jen mělkým dýcháním. Ledová kyselina octová nachází použití jako rozpouštědlo v organických syntézách.
Rejstřík článků
- 1 Historie
- 1,1 1800
- 1.2 1900
- 2 Struktura kyseliny octové
- 3 Fyzikální a chemické vlastnosti
- 3.1 Chemické názvy
- 3.2 Molekulární vzorec
- 3.3 Fyzický vzhled
- 3.4 Zápach
- 3.5 Příchuť
- 3.6 Bod varu
- 3.7 Bod tání
- 3.8 Bod vzplanutí
- 3.9 Rozpustnost ve vodě
- 3.10 Rozpustnost v organických rozpouštědlech
- 3.11 Hustota
- 3.12 Hustota par
- 3.13 Tlak par
- 3.14 Rozklad
- 3.15 Viskozita
- 3.16 Korozivita
- 3.17 Spalné teplo
- 3.18 Odpařovací teplo
- 3,19 pH
- 3.20 Povrchové napětí
- 3,21 pKa
- 3.22 Chemické reakce
- 4 Výroba
- 4.1 Oxidační nebo aerobní fermentace
- 4.2 Anaerobní fermentace
- 4.3 Karbonylace methanolu
- 4.4 Oxidace acetaldehydu
- 5 použití
- 5.1 Průmyslové
- 5.2 Jako rozpouštědlo
- 5.3 Lékaři
- 5.4 V potravinách
- 6 Reference
Příběh
Muž patřící k mnoha kulturám použil fermentaci mnoha druhů ovoce, luštěnin, obilovin atd. K získání alkoholických nápojů, produktu přeměny cukrů, jako je glukóza, na ethanol, CH3CHdvaAch.
Pravděpodobně proto, že počáteční metodou výroby alkoholu a octa je fermentace, možná se pokouší vyrábět alkohol v neurčitém čase, před mnoha staletími, byl ocet získán omylem. Všimněte si podobnosti mezi chemickými vzorci kyseliny octové a ethanolu.
Již ve 3. století před naším letopočtem popsal řecký filozof Theophastus působení octa na kovy pro výrobu pigmentů, jako je olověná bílá.
1800
V roce 1823 bylo v Německu navrženo zařízení ve tvaru věže pro aerobní fermentaci různých produktů za účelem získání kyseliny octové ve formě octa..
V roce 1846 dosáhl Herman Foelbe nejprve syntézy kyseliny octové pomocí anorganických sloučenin. Syntéza začala chlorací sirouhlíku a po dvou reakcích skončila elektrolytickou redukcí na kyselinu octovou.
Na konci 19. a na počátku 20. století se díky výzkumu J. Weizmanna začala bakterie Clostridium acetobutylicum používat k výrobě kyseliny octové pomocí anaerobní fermentace..
1900
Na začátku 20. století byla dominantní technologií výroba kyseliny octové oxidací acetaldehydu.
V roce 1925 navrhl Henry Dreyfus z britské společnosti Celanese pilotní závod na karbonylaci methanolu. Později, v roce 1963, zavedla německá společnost BASF použití kobaltu jako katalyzátoru.
Otto Hromatka a Heinrich Ebner (1949) navrhli nádrž s míchacím systémem a přívodem vzduchu pro aerobní kvašení, určenou pro výrobu octa. Tento nástroj s některými úpravami se stále používá.
V roce 1970 použila severoamerická společnost Montsanto pro karbonylaci methanolu katalytický systém na bázi rhodia..
Společnost BP poté v roce 1990 zavedla proces Cativa s použitím iridiového katalyzátoru pro stejný účel. Ukázalo se, že tato metoda je účinnější a méně ekologicky agresivní než metoda Montsanto..
Struktura kyseliny octové
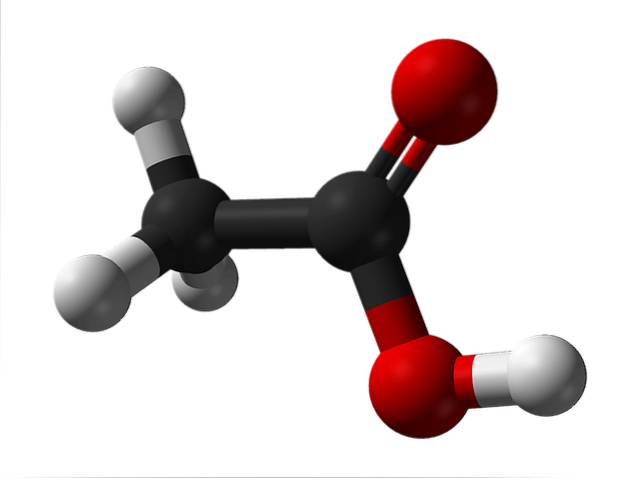
Horní obrázek ukazuje strukturu kyseliny octové znázorněnou modelem koulí a sloupců. Červené koule odpovídají atomům kyslíku, které zase patří do karboxylové skupiny -COOH. Jedná se tedy o karboxylovou kyselinu. Na pravé straně struktury je methylová skupina, -CH3.
Jak je vidět, je to velmi malá a jednoduchá molekula. Představuje trvalý dipólový moment díky skupině -COOH, která také umožňuje kyselině octové tvořit dvě vodíkové vazby za sebou.
Právě tyto mosty prostorově orientují molekuly CH.3COOH za vzniku dimerů v kapalném (a plynném) stavu.
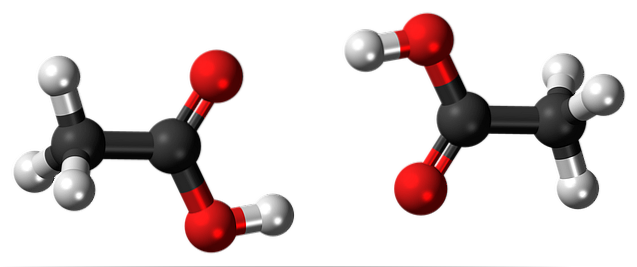
Nahoře na obrázku vidíte, jak jsou tyto dvě molekuly uspořádány tak, aby tvořily dvě vodíkové vazby: O-H-O a O-H-O. K odpaření kyseliny octové musí být dodáno dostatek energie k přerušení těchto interakcí; důvod, proč se jedná o kapalinu s bodem varu vyšším než voda (přibližně 118 ° C).
Fyzikální a chemické vlastnosti
Chemické názvy
Kyselina:
-Octový
-Etanoic
-Ethyl
Molekulární vzorec
CdvaH4NEBOdva nebo CH3COOH.
Fyzický vzhled
Bezbarvá kapalina.
Zápach
Charakteristický akr.
Chuť
Hořící.
Bod varu
244 ° F až 760 mmHg (117,9 ° C).
Bod tání
61,9 ° F (16,6 ° C).
bod vznícení
112 ° F (otevřený kelímek) 104 ° F (uzavřený kelímek).
Rozpustnost ve vodě
106 mg / ml při 25 ° C (je mísitelný ve všech poměrech).
Rozpustnost v organických rozpouštědlech
Je rozpustný v ethanolu, ethyletheru, acetonu a benzenu. Je také rozpustný v tetrachlormethanu.
Hustota
1,051 g / cm3 při 1044 g / cm3 při 25 ° C).
Hustota par
2,07 (vzhledem ke vzduchu = 1).
Tlak páry
15,7 mmHg při 25 ° C.
Rozklad
Při zahřátí nad 440 ° C se rozkládá za vzniku oxidu uhličitého a metanu.
Viskozita
1 056 mPascal při 25 ° C.
Žíravost
Ledová kyselina octová je vysoce žíravá a její požití může u člověka způsobit závažné léze jícnu a pyloru..
Spalné teplo
874,2 kJ / mol.
Odpařovací teplo
23,70 kJ / mol při 117,9 ° C.
23,36 kJ / mol při 25,0 ° C.
pH
-Roztok o koncentraci 1 M má pH 2,4
- U 0,1 M roztoku je jeho pH 2,9
- A 3,4, pokud je řešení 0,01M
Povrchové napětí
27,10 mN / m při 25 ° C.
pKa
4,76 při 25 ° C.
Chemické reakce
Kyselina octová je korozivní pro mnoho kovů a uvolňuje plyn Hdva a vytváření solí kovů zvaných acetáty. S výjimkou octanu chromitého jsou acetáty rozpustné ve vodě. Jeho reakce s hořčíkem je reprezentována následující chemickou rovnicí:
Mg (s) + 2 CH3COOH (ag) => (CH3VRKAT)dvaMg (ag) + Hdva (G)
Redukcí kyselina octová tvoří ethanol. Může také tvořit anhydrid kyseliny octové ze ztráty vody ze dvou molekul vody..
Výroba
Jak již bylo uvedeno, fermentací se získá kyselina octová. Tato fermentace může být aerobní (v přítomnosti kyslíku) nebo anaerobní (bez kyslíku).
Oxidační nebo aerobní fermentace
Bakterie rodu Acetobacter mohou působit na ethanol nebo ethylalkohol a způsobit jeho oxidaci na kyselinu octovou ve formě octa. Touto metodou lze vyrobit ocet s koncentrací 20% kyseliny octové..
Tyto bakterie jsou schopné produkovat ocet a působí na nejrůznější vstupy, které zahrnují různé ovoce, fermentované luštěniny, slad, obiloviny, jako je rýže nebo jiná zelenina, která obsahuje nebo může produkovat ethylalkohol..
Chemická reakce usnadněná bakteriemi rodu Acetobacter je následující:
CH3CHdvaOH + Odva => CH3COOH + HdvaNEBO
Oxidační fermentace se provádí v nádržích s mechanickým mícháním a přívodem kyslíku..
Anaerobní fermentace
Je založen na schopnosti některých bakterií produkovat kyselinu octovou přímým působením na cukry, aniž by k výrobě kyseliny octové byly zapotřebí mezilehlé látky..
C6H12NEBO6 => 3CH3COOH
Bakterií, která v tomto procesu intervenuje, je Clostridium acetobutylicum, které je kromě kyseliny octové schopné zasahovat do syntézy dalších sloučenin..
Acetogenní bakterie mohou produkovat kyselinu octovou a působí na molekuly tvořené pouze jedním atomem uhlíku; takový je případ methanolu a oxidu uhelnatého.
Anaerobní fermentace je levnější než oxidativní fermentace, má však omezení v tom, že bakterie rodu Clostridium nejsou příliš odolné vůči kyselosti. To omezuje jeho schopnost produkovat ocet s vysokou koncentrací kyseliny octové, jaké se dosahuje při oxidační fermentaci..
Karbonylace methanolu
Methanol může reagovat s oxidem uhelnatým za vzniku kyseliny octové v přítomnosti katalyzátorů
CH3OH + CO => CH3COOH
Při použití jodmethanu jako katalyzátoru dochází ke karbonylaci methanolu ve třech stupních:
V prvním stupni reaguje kyselina jodovodíková (HI) s methanolem za vzniku jodmethanu, který ve druhém stupni reaguje s oxidem uhelnatým za vzniku sloučeniny jodacetaldehyd (CH3COI). Dále CH3COI hydratuje za vzniku kyseliny octové a regenerace HI.
Monsanto proces (1966) je metoda výroby kyseliny octové katalytickou karbonylací methanolu. Vyvíjí se při tlaku 30 až 60 atm, při teplotě 150 - 200 ° C a za použití systému rhodiového katalyzátoru..
Proces společnosti Monsanto byl do značné míry nahrazen procesem Cativa (1990) vyvinutým společností BP Chemicals LTD, která používá iridiový katalyzátor. Tento proces je levnější a méně znečišťující.
Oxidace acetaldehydu
Tato oxidace vyžaduje kovové katalyzátory, jako jsou naftenáty, soli manganu, kobalt nebo chrom..
2 CH3CHO + Odva => 2 CH3COOH
Oxidace acetaldehydu může mít velmi vysoký výtěžek, který může u vhodných katalyzátorů dosáhnout 95%. Vedlejší produkty reakce se oddělí od kyseliny octové destilací.
Po metodě karbonylace methanolu je oxidace acetaldehydu druhou formou v procentech průmyslové výroby kyseliny octové.
Aplikace
Průmyslový
-Kyselina octová reaguje s ethylenem v přítomnosti kyslíku za vzniku vinylacetátového monomeru za použití palladia jako reakčního katalyzátoru. Vinylacetát polymeruje na polyvinylacetát, který se používá jako součást barev a lepidel..
-Reaguje s různými alkoholy za vzniku esterů, včetně ethylacetátu a propylacetátu. Acetátové estery se používají jako rozpouštědla pro inkousty, nitrocelulózu, nátěry, laky a akrylové laky..
-Kondenzací dvou molekul kyseliny octové ztrácí jednu molekulu molekuly, anhydrid kyseliny octové, CH3CO-O-COCH3. Tato sloučenina se podílí na syntéze acetátu celulózy, polymeru, který tvoří syntetickou tkaninu, a používá se při výrobě fotografických filmů..
Jako rozpouštědlo
-Je to polární rozpouštědlo se schopností vytvářet vodíkové vazby. Je schopen rozpouštět polární sloučeniny, jako jsou anorganické soli a cukry, ale také rozpouští nepolární sloučeniny, jako jsou oleje a tuky. Navíc je kyselina octová mísitelná s polárními a nepolárními rozpouštědly..
-Mísitelnost kyseliny octové v alkanech závisí na prodloužení jejich řetězce: s rostoucí délkou řetězce alkanů klesá jeho mísitelnost s kyselinou octovou.
Lékaři
-Zředěná kyselina octová se používá jako antiseptikum aplikované lokálně se schopností napadat bakterie, jako jsou streptokoky, stafylokoky a pseudomonády. Díky tomuto účinku se používá při léčbě kožních infekcí.
-Kyselina octová se používá při endoskopii Barrettova jícnu. Jedná se o stav, ve kterém se mění výstelka jícnu a stává se podobnou výstelce tenkého střeva..
-3% gel kyseliny octové se jeví jako účinný doplněk léčby vaginálním lékem Misoprostol, který ve středním trimestru vyvolává potrat v lékařství, zejména u žen s vaginálním pH 5 nebo vyšším..
-Používá se jako náhrada chemického peelingu. S tímto použitím však nastaly komplikace, protože byl hlášen alespoň jeden případ popálenin, které pacient utrpěl.
V jídle
Ocet se již dlouhou dobu používá jako koření a dochucovadlo v potravinách, což z něj činí nejznámější aplikaci kyseliny octové..
Reference
- Byju. (2018). Co je kyselina etanoová? Obnoveno z: byjus.com
- PubChem. (2018). Octová kyselina. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Wikipedia. (2018). Octová kyselina. Obnoveno z: en.wikipedia.org
- Chemická kniha. (2017). Ledová kyselina octová. Obnoveno z: chemicalbook.com
- Kyselina octová: co to je a k čemu je? Obnoveno z: acidoacetico.info
- Helmenstine, Anne Marie, Ph.D. (22. června 2018). Co je kyselina ledová? Obnoveno z: thoughtco.com


Zatím žádné komentáře