
Struktura sulfidu měďnatého, vlastnosti, použití

The sirník měďnatý je skupina anorganických sloučenin, jejichž obecný chemický vzorec je CuXSY. Ano X Je větší než Y to znamená, že uvedený sulfid je bohatší na měď než na síru; a pokud naopak, X Je menší než Y, pak je síra bohatší na síru než měď.
V přírodě převládá řada minerálů, které představují přírodní zdroje této sloučeniny. Téměř všechny jsou bohatší na měď než na síru a jejich složení vyjadřuje a zjednodušuje vzorec CuXS; tady X může dokonce nabývat zlomkové hodnoty, což svědčí o nestechiometrické pevné látce (Cu1,75S, například).

Ačkoli je síra ve svém elementárním stavu žlutá, její odvozené sloučeniny vypadají tmavě; to je také případ sirníku měďnatého. Minerální covelit (horní obrázek), který je složen převážně z CuS, však vykazuje kovový lesk a modravou duhovost..
Mohou být připraveny z různých zdrojů mědi a síry, za použití různých technik a různých parametrů syntézy. Můžete tedy získat nanočástice CuS se zajímavými morfologiemi.
Rejstřík článků
- 1 Struktura sirníku měďnatého
- 1.1 Odkazy
- 1.2 Koordinace v covelita
- 1.3 Jiné krystaly
- 2 Vlastnosti
- 2.1 Obecně
- 2.2 Covelite
- 3 použití
- 3.1 Nanočástice v medicíně
- 3.2 Nanověda
- 4 Odkazy
Struktura sirníku měďnatého
Odkazy
Tato sloučenina vypadá, že je krystalická, takže si lze okamžitě myslet, že je složena z iontů Cu+ (jednomocná měď), Cudva+ (dvojmocná měď), Sdva- a včetně Sdva- a S.dvadva- (disulfidové anionty), které interagují prostřednictvím elektrostatických sil nebo iontové vazby.
Mezi Cu a S však existuje mírný kovalentní charakter, a proto nelze vyloučit vazbu Cu-S. Z tohoto důvodu se krystalická struktura CuS (a všech jejích odvozených pevných látek) začíná lišit od struktur nalezených nebo charakterizovaných pro jiné iontové nebo kovalentní sloučeniny..
Jinými slovy, nemůžeme mluvit o čistých iontech, ale uprostřed jejich přitažlivosti (kation-anion) dochází k mírnému překrývání jejich vnějších orbitalů (sdílení elektronů).
Koordinace v la covelita
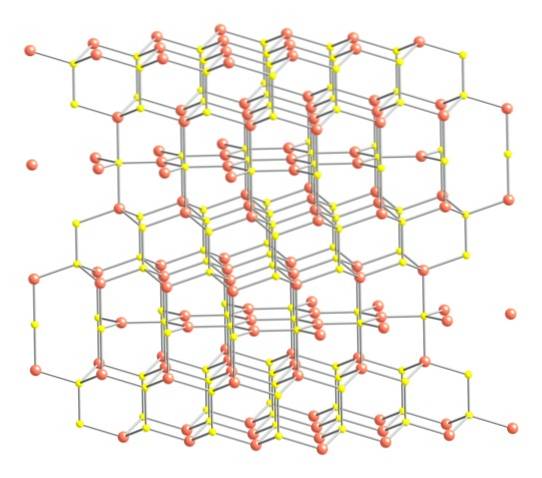
Po výše uvedeném je krystalová struktura covelitu zobrazena na horním obrázku. Skládá se z hexagonálních krystalů (definovaných parametry jejich jednotkových buněk), kde se ionty spojují a orientují se v různých koordinacích; tito jsou, s různým počtem blízkých sousedů.
Na obrázku jsou ionty mědi reprezentovány růžovými koulemi, zatímco ionty síry jsou reprezentovány žlutými koulemi..
Zaměříme-li pozornost nejprve na růžové koule, je třeba poznamenat, že některé jsou obklopeny třemi žlutými koulemi (koordinace trigonální roviny) a jiné čtyřmi (čtyřboká koordinace)..
První typ mědi, trigonální, lze identifikovat v rovinách kolmých k šestihranným plochám obráceným ke čtečce, ve kterých jsou zase druhý typ uhlíku, čtyřboká.
Pokud jde o žluté koule, některé mají jako sousedky pět růžových koulí (koordinace trigonálních bipyramidů), jiné tři a žlutou sféru (opět čtyřboká koordinace); V druhém případě je vidět disulfidový anion, který je vidět níže a ve stejné struktuře covelitu:
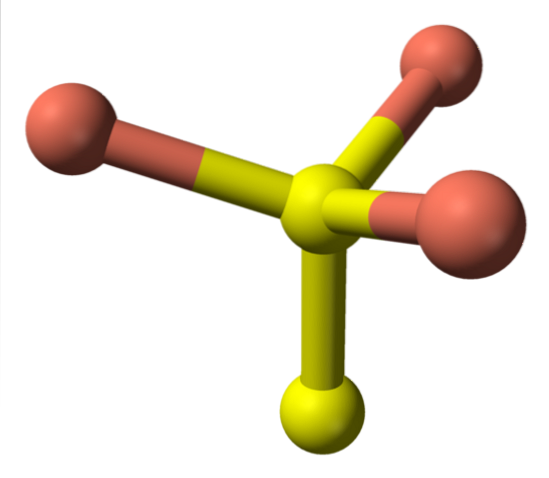
Alternativní vzorec
Pak existují ionty Cudva+, Cu+, Sdva- a S.dvadva-. Studie prováděné pomocí rentgenové fotoelektronové spektroskopie (XPS) však ukazují, že veškerá měď je jako kationty Cu+; a proto je počáteční vzorec CuS vyjádřen „lépe“ jako (Cu+)3(S.2−) (S.dva)-.
Všimněte si, že poměr Cu: S pro výše uvedený vzorec je i nadále 1 a poplatky se dále ruší.
Ostatní krystaly
Sulfid měďnatý může přijímat ortorombické krystaly, jako v polymorfu, y-CudvaS, od chalkokitu; krychlový, jako v jiném polymorfu chalcocitu, α-CudvaS; tetragonální, v minerálu anilit, Cu1,75S; monokliniky, v djurleita, Cu1,96Ano, mimo jiné.
Pro každý definovaný krystal existuje minerál a každý minerál má zase své vlastní vlastnosti a vlastnosti.
Vlastnosti
Všeobecné
Vlastnosti sulfidu mědi podléhají poměru Cu: S jeho pevných látek. Například ti s S aniontydvadva- mají šestihranné struktury a mohou to být buď polovodiče nebo kovové vodiče.
Pokud naopak obsah síry sestává pouze z aniontů Sdva-, sulfidy se chovají jako polovodiče a také vykazují iontové vodivosti při vysokých teplotách. Je to proto, že jeho ionty začínají vibrovat a pohybovat se uvnitř krystalů, čímž přenášejí elektrické náboje..
Opticky, i když to také závisí na jejich složení mědi a síry, mohou sulfidy absorbovat nebo ne absorbovat záření v infračervené oblasti elektromagnetického spektra. Tyto optické a elektrické vlastnosti umožňují implementaci potenciálních materiálů do různých rozsahů zařízení..
Další proměnnou, kterou je třeba vzít v úvahu, je kromě poměru Cu: S také velikost krystalů. Nejde jen o to, že existuje více „sirných“ nebo „měděných“ sulfidů mědi, ale rozměry jejich krystalů dodávají nepřesný účinek na jejich vlastnosti; Vědci tedy touží studovat a hledat aplikace nanočástic Cu.XSY.
Covelite
Každý minerál nebo sulfid mědi má jedinečné vlastnosti. Ze všech je však covelite nejzajímavější ze strukturálního a estetického hlediska (díky své duhovosti a modrým tónům). Proto jsou některé z jeho vlastností uvedeny níže.
Molární hmotnost
95,611 g / mol.
Hustota
4,76 g / ml.
Bod tání
500 ° C; ale rozpadá se.
Rozpustnost ve vodě
3,3 10-5 g / 100 ml při 18 ° C.
Aplikace
Nanočástice v medicíně
Nejen, že se velikost částic mění, dokud nedosáhnou nanometrických rozměrů, ale jejich morfologie se také mohou velmi lišit. Sulfid měďnatý tak může vytvářet nanosféry, tyče, desky, tenké filmy, klece, kabely nebo trubice..
Tyto částice a jejich atraktivní morfologie získávají jednotlivé aplikace v různých oblastech medicíny..
Například nanoklece nebo prázdné koule mohou sloužit jako nosiče léků v těle. Nanosféry byly použity, podporovány elektrodami z uhlíkového skla a uhlíkovými nanotrubičkami, aby fungovaly jako detektory glukózy; stejně jako jeho agregáty jsou citlivé na detekci biomolekul, jako je DNA.
CuS nanotrubice překonávají nanosféry v detekci glukózy. Kromě těchto biomolekul byly imunosenzory navrženy z tenkých vrstev CuS a určitých podpůrných prostředků pro detekci patogenů..
Nanokrystaly a amorfní agregáty CuS mohou dokonce způsobit apoptózu rakovinných buněk, aniž by způsobily poškození zdravých buněk.
Nanovědy
V předchozí podsekci bylo řečeno, že její nanočástice byly součástí biosenzorů a elektrod. Kromě těchto použití využili vědci a technici také jeho vlastnosti k návrhu solárních článků, kondenzátorů, lithiových baterií a katalyzátorů pro velmi specifické organické reakce; Nepostradatelné prvky v nanovědách.
Za zmínku stojí také to, že při podpoře aktivním uhlím se ukázalo, že sada NpCuS-CA (CA: Aktivní uhlí a Np: Nanočástice) slouží jako odstraňovač barviv škodlivých pro člověka, a proto funguje jako čistič zdrojů voda absorbující nežádoucí molekuly.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Sulfid měďnatý. Obnoveno z: en.wikipedia.org
- Ivan Grozdanov a Metodija Najdoski. (devatenáct devadesát pět). Optické a elektrické vlastnosti filmů se sulfidem měďnatým různého složení. Journal of Solid State Chemistry, svazek 114, číslo 2, 1. února 1995, strany 469-475. doi.org/10.1006/jssc.1995.1070
- Národní centrum pro biotechnologické informace. (2019). Sulfid měďnatý (CuS). Databáze PubChem. CID = 14831. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Peter A. Ajibade a Nandipha L. Botha. (2017). Syntéza, optické a strukturní vlastnosti
- nanokrystalů sulfidu měďnatého z prekurzorů jedné molekuly. Department of Chemistry, University of Fort Hare, Private Bag X1314, Alice 5700, South Africa. Nanomateriály, 7, 32.
- Spolupráce: Autoři a redaktoři svazků III / 17E-17F-41C (s.f.). Krystalová struktura sulfidů mědi (Cu2S, Cu (2-x) S), parametry mřížky. In: Madelung O., Rössler U., Schulz M. (eds) Non-Tetrahedrally Bonded Elements and Binary Compounds I. Landolt-Börnstein- Group III Condensed Matter (Numerical Data and Functional Relationships in Science and Technology), vol 41C. Springer, Berlín, Heidelberg.
- Momtazan, F., Vafaei, A., Ghaedi, M. a kol. Korean J. Chem. Eng. (2018). Aplikace aktivního uhlí naplněného nanočásticemi sulfidu mědi pro současnou adsorpci ternárních barviv: Metodika povrchové odezvy. 35: 1108. doi.org/10.1007/s11814-018-0012-1
- Goel, S., Chen, F. a Cai, W. (2014). Syntéza a biomedicínské aplikace nanočástic sulfidu měďnatého: od senzorů po terapeutiku. Malý (Weinheim an der Bergstrasse, Německo), 10 (4), 631-645. doi: 10,1002 / smll.201301174



Zatím žádné komentáře