
Vlastnosti, rizika a použití kyseliny bromové (HBrO3)
The kyselina bromová, Také známý jako hydrogenuhličitan nebo kyselina bromová (V), je to chemická sloučenina se vzorcem HBrO3. Jedná se o kyselinu bromovou se strukturou analogickou s kyselinou chlorovou (EMBL-EBI, 2014). Sloučenina je velmi silná kyselina. Jeho struktura je uvedena na obrázku 1 (EMBL-EBI, 2008).
Pro přípravu kyseliny bromové se rozpustný bromičnan obvykle rozpustí ve vodě a přidá se rozpustná sůl barnatého. Sráží se málo rozpustný bromičnan barnatý.
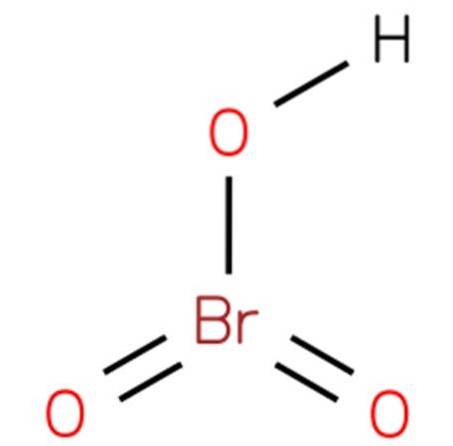
Bromičnan barnatý lze poté rozpustit ve vodě a okyselit kyselinou sírovou, aby se vysrážel v podstatě nerozpustný síran barnatý a zanechala se kyselina bromová za sebou (viz obrázek výše):
2KBrO3 (aq) + BaCl2 (aq) -> Ba (BrO3) 2 (s) + 2KCl (aq)
Ba (BrO3) 2 (aq) + H2SO4 (aq) -> 2HBrO3 + BaSO4
Sloučenina může být také vyrobena rozkladem chloridu bromitého v alkalickém roztoku podle reakce:
BrCl5 + 3 H2O → HBrO3 + 5 HCl
Kyselina bromová je silné oxidační činidlo. Bromičnanový iont může být dále oxidován elementárním fluorem nebo xenon difluoridem v přítomnosti báze, oxidace doprovázená malými výbuchy a teflonová trubice chycená v ohni (My Favorite Chemicals, S.F.).
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti kyseliny bromové
- 2 Reaktivita a nebezpečí
- 2.1 V případě kontaktu s očima
- 2.2 V případě kontaktu s pokožkou
- 2.3 V případě vdechnutí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti kyseliny bromové
Kyselina bromičitá existuje pouze v bezbarvém roztoku (až 50% hmotn./obj.), Který při kontaktu se vzduchem zbarví nažloutle (National Center for Biotechnology Information., 2017). Jeho vzhled je znázorněn na obrázku 2.

Sloučenina má molekulovou hmotnost 128,91 g / mol a rozkládá se při 100 ° C a má pKa -2. Jelikož jde o nestabilní sloučeninu, její fyzikálně-chemické vlastnosti byly získány výpočtovými výpočty..
Má bod tání 206,04 ° C, bod varu 517,26 ° C a rozpustnost ve vodě 1 x 106 mg / l při 25 ° C (Royal Society of Chemistry, 2015).
Sloučenina je silné oxidační činidlo. Po smíchání s ethanolem nebo etherem se při exotermické reakci rozloží na kyselinu octovou. Je nezbytný pro výrobu bromičnanových solí (BrO3-), které se připravují reakcí uhličitanů nebo oxidů kovů s kyselinou bromičitou (Watts, 1870).
Reaktivita a nebezpečí
Kyselina bromová je nestabilní sloučenina rozkládající se na elementární brom. Jelikož je silnou kyselinou, je extrémně nebezpečný při kontaktu s pokožkou (žíravý a dráždivý), při kontaktu s očima (dráždivý) a při požití. Velmi nebezpečné také v případě vdechnutí.
Silné nadměrné vystavení může způsobit poškození plic, udušení, ztrátu vědomí nebo smrt. Dlouhodobá expozice může způsobit popáleniny a ulcerace kůže. Nadměrná expozice vdechováním může způsobit podráždění dýchacích cest..
Zánět oka je charakterizován zarudnutím, slzením a svěděním. Zánět kůže je charakterizován svěděním, olupováním, zarudnutím a občasnými puchýři.
Látka je toxická pro ledviny, plíce a sliznice. Opakované nebo dlouhodobé vystavení látce může způsobit poškození těchto orgánů..
V případě kontaktu s očima
Zkontrolujte, zda nejsou kontaktní čočky nasazené, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž by měla být víčka otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
V případě kontaktu s pokožkou
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem. Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem..
V případě vdechnutí
Doporučuje se nechat postiženého odpočívat na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata. Pokud postižený dýchá obtížně, měl by být podán kyslík.
Pokud postižený nedýchá, provede se resuscitace z úst do úst. Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Při požití nevyvolávejte zvracení. Uvolněte těsné oblečení, jako jsou límce košile, opasky nebo kravaty. Pokud postižený nedýchá, proveďte resuscitaci z úst do úst.
Ve všech případech okamžitě vyhledejte lékařskou pomoc..
Aplikace
Kyselina bromičitá se používá jako silné oxidační činidlo při laboratorních reakcích. Používá se k výrobě chemických sloučenin, jako jsou jodičnany, kyselina chlorovodíková, kyselina tetraihonová a další..
Používá se také k výrobě bromičnanů, jako je železo, olovo, mangan a bromičnan rtuťnatý..
Kyselina bromová působí jako důležitý meziprodukt v Bélousov-Zhabotinské reakci (Morris, 2010). Tato reakce je příkladem chemických hodin a ilustruje termodynamickou nerovnovážnou reakci.
Oscilační reakce je katalyzována cerem a je neodmyslitelně spojena s chemií oxokyselin bromu HBrOx. Rostoucí zájem o nelineární chemické systémy poskytl silné podněty ke studiu chemie bromu..
V reakci Belousov-Zhabotinsky jsou zúčastněnými sloučeninami bromu kyselina bromná HOBr, kyselina bromitá HOBrO a kyselina bromičná HBrO3 (3) (Rainer Glaser, 2013).
Tyto typy reakcí jsou důležité pro teoretickou chemii. Ukazují, že chemickým reakcím nemusí dominovat rovnovážné termodynamické chování.
Reference
- Kyselina bromičitá. (S.F.). Obnoveno z chemyq.com.
- EMBL-EBI. (2008, 16. května). kyselina bromová. Obnoveno z ebi.ac.uk.
- EMBL-EBI. (2014, 28. července). kyselina chlorovodíková. Obnoveno z ebi.ac.uk.
- Morris, S. (2010, 23. ledna). Belousov Zhabotinsky reakce 8 x normální rychlost. Obnoveno z youtubecom.
- Moje oblíbené chemikálie. (S.F.). Obnoveno z bromicacid.com.
- Národní centrum pro biotechnologické informace. (2017, 11. března). Složená databáze PubChem; CID = 24445 ,. Citováno z PubChem.
- Rainer Glaser, M. D. (2013). Proč je pro kinetické modely Belousov-Zhabotinského oscilačních chemických reakcí skutečně důležitá kyselost kyseliny bromové. Journal of Thermodynamics & Catalysis 4: 1.
- Royal Society of Chemistry. (2015). Kyselina bromičitá. Obnoveno z chemspider.com.
- Watts, H. (1870). Slovník chemie a příbuzných oborů jiných věd, svazek 1. London: longmans, green and co.



Zatím žádné komentáře