
Jaké jsou hmotnostní zákony chemie? (Příklady)
The hmotnostní zákony chemie Jsou to ti, kteří prokázali, že masy reagujících látek tak nedělají svévolně nebo nahodile; ale udržováním konstantního matematického podílu celých čísel nebo jejich podskupin, ve kterých atomy prvků nejsou ani vytvářeny, ani ničeny.
V dobách minulých, kdy bylo stanovování těchto zákonů vyžadováno mimořádné úsilí uvažování; protože i když se to nyní zdá příliš zřejmé, dříve, než byly známy ani atomové nebo molekulární hmotnosti prvků nebo sloučenin.

Jelikož nebylo přesně známo, kolik se jeden mol atomů každého prvku rovnal, museli se chemici v 18. a 19. století spolehnout na reagující masy. Základní analytické váhy (horní obrázek) byly tedy neoddělitelnými společníky během stovek experimentů potřebných k vytvoření zákonů o hmotnosti..
Z tohoto důvodu při studiu těchto chemických zákonů narazíte v každém okamžiku na hromadná měření. Díky tomu, extrapolace výsledků experimentů, bylo zjištěno, že chemické sloučeniny doutníky jsou vždy tvořeny se stejným hmotnostním podílem jejich základních prvků.
Rejstřík článků
- 1 Zákon o zachování mše
- 1.1 -Lavoisierovy experimenty
- 1.2 - Rovnice rovnic
- 1.3 - Výpočty
- 2 Zákon určitých rozměrů
- 2.1 - Ilustrace zákona
- 2.2 - Aplikace
- 2.3 - Výpočty
- 3 Zákon několika rozměrů nebo Daltonův zákon
- 3.1 - Výpočty
- 4 Zákon vzájemných proporcí
- 4.1 - Příklady
- 5 Reference
Zákon zachování hmoty
Tento zákon říká, že v chemické reakci se celková hmotnost reaktantů rovná celkové hmotnosti produktů; pokud je uvažovaný systém uzavřen a nedochází k výměně hmoty a energie s okolím.
Při chemické reakci látky nezmizí, ale přemění se na jiné látky stejné hmotnosti; odtud pochází slavná fráze: „nic není vytvořeno, nic není zničeno, všechno je transformováno“.
Historicky byl zákon zachování hmoty v chemické reakci poprvé navržen v roce 1756 Michailem Lomonsovem, který ve svém deníku ukázal výsledky svých experimentů..
Později v roce 1774 představil francouzský chemik Antoine Levoisier výsledky svých experimentů, které to umožnily; což někteří také nazývají Lavoisierův zákon.
-Lavoisierovy experimenty
V Lavoisierově době (1743-1794) existovala Phlogistonova teorie, podle které těla měla schopnost vznítit nebo hořet. Lavoisierovy experimenty umožnily tuto teorii zahodit.
Lavoisier provedl řadu experimentů se spalováním kovů. Pečlivě zvážil materiály před a po spalování v uzavřené nádobě a zjistil, že došlo ke zjevnému přírůstku hmotnosti..
Ale Lavoiser na základě svých znalostí úlohy kyslíku při spalování dospěl k závěru, že přírůstek hmotnosti při spalování byl způsoben zabudováním kyslíku do hořícího materiálu. Koncept oxidů kovů se zrodil.
Součet hmotností kovů vystavených spalování a kyslíku proto zůstal nezměněn. Tento závěr umožnil zavedení zákona o zachování mše.
-Vyrovnávání rovnic
Zákon zachování hmot stanovil potřebu vyvážení chemických rovnic a zaručil, že počet všech prvků, které se účastní chemické reakce, ať už jako reaktanty nebo jako produkty, je přesně stejný..
Toto je základní požadavek na přesnost stechiometrických výpočtů, které mají být provedeny..
-Výpočty
Vodní krtci
Kolik molů vody může vzniknout při spalování 5 molů metanu v přebytku kyslíku? Ukažte také, že zákon zachování hmoty je splněn..
CH4 + 2 O.dva => COdva + 2 hdvaNEBO
Při dodržení vyvážené rovnice reakce se dospělo k závěru, že 1 mol metanu produkuje 2 moly vody.
Problém lze vyřešit přímo jednoduchým přístupem, protože nemáme 1 mol, ale 5 mol CH4:
Mole vody = 5 mol CH4(2 moly HdvaO / 1 mol CH4)
= 10
Což by odpovídalo 180 g HdvaO. Také se vytvořil 5 mol nebo 220 g COdva, což se rovná celkové hmotnosti 400 g výrobků.
Aby byl splněn zákon zachování hmoty, musí reagovat 400 g činidel; nic víc, nic míň. Z těchto 400 g odpovídá 80 g 5 molům CH4 (vynásobeno molekulovou hmotností 16 g / mol) a 320 g při 10 molech Odva (podobně pro svou molekulovou hmotnost 32 g / mol).
Spalování hořčíkové pásky
1,50 g hořečnatý pás byl spálen v uzavřené nádobě obsahující 0,80 g kyslíku. Po spalování zůstalo v nádobě 0,25 g kyslíku. a) Jaké množství kyslíku reagovalo? b) Kolik oxidu hořečnatého bylo vytvořeno?
Hmotnost reagujícího kyslíku se získá jednoduchým rozdílem.
Hmotnost spotřebovaného kyslíku = (počáteční hmotnost - zbytková hmotnost) kyslíku
= 0,80 g - 0,25 g
= 0,55 g Odva (na)
Podle zákona zachování hmoty,
Hmotnost oxidu hořečnatého = hmotnost hořčíku + hmotnost kyslíku
= 1,50 g + 0,55 g
= 2,05 g MgO (b)
Zákon určitých rozměrů
Joseph Louis Proust (1754-1826), francouzský chemik, si uvědomil, že při chemické reakci chemické prvky vždy reagují ve stálých poměrech hmot za vzniku sloučeniny čistý charakteristický; proto je jeho složení konstantní bez ohledu na zdroj nebo původ nebo na způsob jeho syntézy.
Proust v roce 1799 vyslovil zákon definitivních rozměrů, který uvádí, že: „Když se dva nebo více prvků spojí a vytvoří sloučeninu, učiní tak v poměru pevné hmotnosti.“ Poté je tento vztah pevný a nezávisí na strategii použité pro přípravu sloučeniny..
Tento zákon je také známý jako zákon konstantního složení, který říká, že: „Každá chemická sloučenina ve stavu čistoty vždy obsahuje stejné prvky v konstantním podílu hmotnosti.“.
-Zákon ilustrace
Železo (Fe) reaguje se sírou (S) za vzniku sulfidu železa (FeS), lze zaznamenat tři situace (1, 2 a 3):
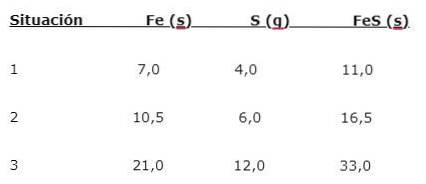
Chcete-li zjistit poměr, ve kterém se prvky kombinují, vydělte větší hmotu (Fe) menší hmotou (S). Výpočet dává poměr 1,75: 1. Tato hodnota se opakuje za daných tří podmínek (1, 2 a 3), kde se získá stejný podíl, i když se používají různé hmotnosti..
To znamená, že 1,75 g Fe se spojí s 1,0 g S, čímž se získá 2,75 g FeS.
-Aplikace
Použitím tohoto zákona je možné přesně znát hmotnosti prvků, které je třeba kombinovat, abychom získali požadovanou hmotnost sloučeniny..
Tímto způsobem lze získat informace o přebytečném množství některého z prvků zapojených do chemické reakce nebo o tom, zda je v reakci omezující činidlo..
Kromě toho se aplikuje znalost centesimálního složení sloučeniny a na jejím základě lze stanovit vzorec sloučeniny.
Centimální složení sloučeniny
Oxid uhličitý (COdva) vzniká při následující reakci:
C + Odva => COdva
12 g uhlíku kombinuje 32 g kyslíku za vzniku 44 g oxidu uhličitého.
Takže procento uhlíku se rovná
Procento uhlíku = (12 g / 44 g) 100%
= 27,3%
Procento kyslíku = (32 g / 44 g) 100%
Procento kyslíku = 72,7%
Při použití zákona o stálém složení lze poznamenat, že oxid uhličitý je vždy tvořen 27,3% uhlíku a 72,7% kyslíku.
-Výpočty
Oxid siřičitý
Když reagovaly 4 g a 6 g síry (S) s kyslíkem (O) v různých nádobách, 10 g a 15 g oxidu sírového (SO3).
Proč byla získána taková množství oxidu sírového a ne jiná?
Vypočítejte také množství síry potřebné ke smíchání s 36 g kyslíku a hmotou získaného oxidu sírového.
Část A)
V první nádobě se 4 síry smísí s X g kyslíku, čímž se získá 10 g oxidu. Pokud se použije zákon zachování hmoty, můžeme vyřešit hmotnost kyslíku, který se spojil se sírou.
Hmotnost kyslíku = 10 g oxidu kyslíku - 4 g síry.
= 6 g
V nádobě 2 se smísí 6 g síry s X g kyslíku, čímž se získá 15 oxidu sírového.
Hmotnost kyslíku = 15 g oxidu sírového - 6 g síry
= 9 g
Poté pokračujeme k výpočtu poměrů O / S pro každý kontejner:
Poměr O / S v situaci 1 = 6 g O / 4 g S
= 1,5 / 1
Poměr O / S v situaci 2 = 9 g O / 6 g S
= 1,5 / 1
Což je v souladu s tím, co je uvedeno v zákoně o definovaných proporcích, což naznačuje, že prvky se vždy spojují ve stejném poměru a tvoří určitou sloučeninu..
Získané hodnoty jsou proto správné a hodnoty, které odpovídají aplikaci zákona.
Část b)
V předchozí části byla pro poměr O / S vypočítána hodnota 1,5 / 1.
g síry = 36 kyslíku (1 g síry / 1,5 g kyslíku)
= 24 g
g oxidu sírového = 36 g kyslíku + 24 g síry
= 60 g
Chlor a hořčík
Chlor a hořčík se kombinují v poměru 2,95 g chloru na každý gram hořčíku. a) Stanoví se množství chloru a hořčíku potřebné k získání 25 g chloridu hořečnatého. b) Jaké je procentuální složení chloridu hořečnatého?
Část A)
Na základě hodnoty 2,95 pro poměr Cl: Mg lze provést následující přístup:
2,95 g Cl + 1 g Mg => 3,95 g MgCldva
Později:
g Cl = 25 g MgCldva (2,95 g Cl / 3,95 g MgCldva)
= 18,67
g Mg = 25 g MgCldva (1 g Mg / 3,95 g MgCldva)
= 6,33
Takže 18,67 g chloru se spojí s 6,33 g hořčíku za vzniku 25 g chloridu hořečnatého..
Část b)
Nejprve vypočítejte molekulovou hmotnost chloridu hořečnatého, MgCldva:
Molekulová hmotnost MgCldva = 24,3 g / mol + (2 35,5 g / mol)
= 95,3 g / mol
Procento hořčíku = (24,3 g / 95,3 g) x 100%
= 25,5%
Procento chloru = (71 g / 95,3 g) x 100%
= 74,5%
Zákon několika rozměrů nebo Daltonův zákon
Zákon byl vyhlášen v roce 1803 francouzským chemikem a meteorologem Johnem Daltonem na základě jeho pozorování ohledně reakcí atmosférických plynů.
Zákon byl stanoven následujícím způsobem: „Když se prvky spojí, aby poskytly více než jednu sloučeninu, spojí se proměnná hmotnost jednoho z nich s pevnou hmotností druhého a první má vztah kanonických a nezřetelných čísel“.
Také: „Když jsou dva prvky kombinovány za vzniku různých sloučenin, vzhledem k pevnému množství jedné z nich, různá množství druhého prvku, která se spojí s uvedeným pevným množstvím za vzniku sloučenin, jsou ve vztahu k jednoduchým celým číslům“.
John Dalton provedl první moderní popis atomu jako součásti chemických prvků, když poukázal na to, že prvky jsou tvořeny nedělitelnými částicemi zvanými atomy..
Kromě toho předpokládal, že sloučeniny vznikají, když se atomy různých prvků navzájem kombinují v jednoduchých celočíselných poměrech..
Dalton dokončil vyšetřovací práce Prousta. Poukázal na existenci dvou oxidů cínu s procenty 88,1% a 78,7% cínu s odpovídajícími procenty kyslíku, 11,9%, respektive 21,3%..
-Výpočty
Voda a peroxid vodíku
Ukažte, že sloučeniny voda, HdvaO a peroxid vodíku, HdvaNEBOdva, dodržovat zákon o více poměrech.
Atomové hmotnosti prvků: H = 1 g / mol a kyslík = 16 g / mol.
Molekulové hmotnosti sloučenin: HdvaO = 18 g / mol a HdvaNEBOdva = 34 g / mol.
Vodík je prvek s pevným množstvím v HdvaO a HdvaNEBOdva, takže budou stanoveny proporce mezi O a H v obou sloučeninách.
Poměr O / H v HdvaO = (16 g / mol) / (2 g / mol)
= 8/1
Poměr O / H v HdvaNEBOdva = (32 g / mol) / (2 g / mol)
= 16/1
Vztah mezi oběma proporcemi = (16/1) / (8/1)
= 2
Takže poměr O / H peroxidu vodíku k vodě je 2, jednoduché celé číslo. Proto je prokázán soulad se zákonem o více poměrech..
Oxidy dusíku
Jaké množství kyslíku se kombinuje s 3,0 g dusíku v a) oxidu dusnatém, NO ab) v oxidu dusičitém, NOdva. Ukažte, že NE a NEdva dodržovat zákon o více poměrech.
Hmotnost dusíku = 3 g
Atomové hmotnosti: dusík, 14 g / mol a kyslík, 16 g / mol.
Výpočty
V NO se jeden atom N kombinuje s 1 atomem O, takže hmotnost kyslíku kombinovaného s 3 g dusíku lze vypočítat pomocí následujícího přístupu:
g O = g dusíku · (PA. O / PA. N)
= 3 g (16 g / mol / 14 g / mol)
= 3,43 g O
V NOdva, jeden atom N se kombinuje s 2 atomy O, takže hmotnost kyslíku, která je kombinována, je:
g kyslíku = 3 g (32 g / mol / 14 g / mol)
= 6,86 g O
Poměr O / N v NO = 3,43 g O / 3 g N
= 1143
Poměr O / N v NOdva = 6,86 g O / 3 g N
= 2282
Hodnota vztahu mezi poměry O / N = 2,282 / 1,143
= 2
Hodnota poměru O / N je tedy 2, jednoduché celé číslo. Proto je zákon vícenásobných proporcí splněn..
Zákon o vzájemných poměrech
Tento zákon formulovaný Richterem a Carlem F. Wenzelem samostatně stanoví, že hmotnostní poměry dvou sloučenin se společným prvkem umožňují určit podíl třetí sloučeniny mezi ostatními prvky, pokud reagují.
Například pokud máte dvě sloučeniny AB a CB, můžete vidět, že společným prvkem je B.
Richter-Wenzelův zákon nebo zákon o vzájemných poměrech říká, že když víme, kolik A reaguje s B na AB, a kolik C reaguje s B na CB, můžeme vypočítat množství A, které je potřeba k reakci s hmota C za vzniku AC.
A výsledkem je, že poměr A: C nebo A / C musí být násobkem nebo vícenásobkem A / B nebo C / B. Tento zákon však není vždy splněn, zvláště když prvky vykazují různé oxidační stavy..
Ze všech hlavních zákonů je to možná nejvíce „abstraktní“ nebo komplikované. Pokud je však analyzována z matematického hlediska, bude vidět, že se skládá pouze z konverzních faktorů a zrušení.
-Příklady
Metan
Pokud je známo, že 12 g uhlíku reaguje s 32 g kyslíku za vzniku oxidu uhličitého; a že na druhé straně 2 g vodíku reagují se 16 g kyslíku za vzniku vody, pak lze odhadnout hmotnostní podíly C / O a H / O pro COdva a HdvaNebo příslušně.
Výpočet C / O a H / O máme:
C / O = 12 g C / 32 g O.
= 3/8
H / O = 2 g H / 16 g O
= 1/8
Kyslík je běžným prvkem a chcete vědět, kolik uhlíku reaguje s vodíkem za vzniku methanu; to znamená, že chcete vypočítat C / H (nebo H / C). Poté je nutné provést rozdělení předchozích proporcí, abychom ukázali, zda je či není splněna vzájemnost:
C / H = (C / O) / (H / O)
Všimněte si, že tímto způsobem jsou O zrušena a C / H zůstává:
C / H = (3/8) / (1/8)
= 3
A 3 je násobek 3/8 (3/8 x 8). To znamená, že 3 g C reaguje s 1 g H za vzniku methanu. Ale aby to bylo možné porovnat s COdva, vynásobte C / H 4, což se rovná 12; Tím se získá 12 g C, který reaguje se 4 g H za vzniku methanu, což je také pravda.
Sulfid hořečnatý
Pokud je známo, že 24 g hořčíku reaguje s 2 g vodíku za vzniku hydridu hořečnatého; a že navíc 32 g síry reaguje s 2 g vodíku za vzniku sirovodíku, společným prvkem je vodík a chceme vypočítat Mg / S z Mg / H a H / S.
Výpočet Mg / H a H / S samostatně pak:
Mg / H = 24 g Mg / 2 g H
= 12
H / S = 2 g H / 32 g S
= 1/16
Je však vhodné použít S / H pro zrušení H. Proto je S / H rovné 16. Jakmile je to hotové, přistoupíme k výpočtu Mg / S:
Mg / S = (Mg / H) / (S / H)
= (12/16)
= 3/4
A 3/4 je submultiple 12 (3/4 x 16). Poměr Mg / S naznačuje, že 3 g Mg reaguje se 4 g síry za vzniku sirníku hořečnatého. Musíte však vynásobit Mg / S číslem 8, abyste jej mohli porovnat s Mg / H. 24 g Mg tedy reaguje s 32 g síry za vzniku tohoto sulfidu kovu.
Chlorid hlinitý
Je známo, že 35,5 g Cl reaguje s 1 g H za vzniku HCl. Podobně 27 g Al reaguje s 3 g H za vzniku AlH3. Vypočítejte podíl chloridu hlinitého a řekněte, zda taková sloučenina splňuje Richter-Wenzelův zákon.
Opět postupujeme k výpočtu Cl / H a Al / H samostatně:
Cl / H = 35,5 g Cl / 1 g H
= 35,5
Al / H = 27 g Al / 3 g H
= 9
Nyní se vypočítá Al / Cl:
Al / Cl = (Al / H) / (Cl / H)
= 9 / 35,5
≈ 0,250 nebo 1/4 (ve skutečnosti 0,253)
To znamená, že 0,250 g Al reaguje s 1 g Cl za vzniku odpovídající soli. Ale opět musí být Al / Cl vynásoben číslem, které umožňuje jeho srovnání (pro větší pohodlí) s Al / H.
Nepřesnosti výpočtu
Al / Cl se poté vynásobí 108 (27 / 0,250), čímž se získá 27 g Al, který reaguje se 108 g Cl. To není přesně tento případ. Vezmeme-li například hodnotu 0,253krát Al / Cl a vynásobíme-li ji 106,7 (27 / 0,253), dostaneme, že 27 g Al reaguje se 106,7 g Cl; což je blíže realitě (AlCl3, s PA 35,5 g / mol pro Cl).
Zde je uvedeno, jak může Richterův zákon začít váhat kvůli přesnosti a zneužití desetinných míst..
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Flores, J. Química (2002). Redakční Santillana.
- Joaquín San Frutos Fernández. (s.f.). Ponderální a volumetrické zákony. Obnoveno z: encina.pntic.mec.es
- Toppr. (s.f.). Zákony chemické kombinace. Obnoveno z: toppr.com
- Brilantní. (2019). Zákony chemické kombinace. Obnoveno z: brilliant.org
- Chemistry LibreTexts. (2015, 15. července). Základní chemické zákony. Obnoveno z: chem.libretexts.org
- Helmenstine, Anne Marie, Ph.D. (18. ledna 2019). Zákon zachování mše. Obnoveno z: thoughtco.com



Zatím žádné komentáře