
Vzorec kyseliny chlorovodíkové (HClO2), vlastnosti a použití

The kyselina chloritá je anorganická sloučenina vzorce HClOdva. Uvedená kyselina je jednou z kyselin oxokyselin chloru, kde je v oxidačním stavu 3+. I když je těžké získat kyselinu ve své čisté látce, konjugovaná báze odvozená od těchto kyselin, chloritanový ion, je stabilní..
Příkladem soli tohoto aniontu je známý chloritan sodný. Tato a související soli se někdy používají při výrobě oxidu chloričitého..
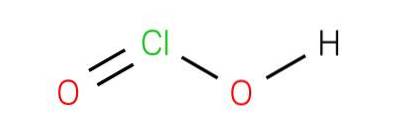
Kyselina chlorovodíková je slabá kyselina. Čistá látka je nestabilní, nepřiměřená vůči kyselině chlorné (oxidační stav Cl +1) a kyselině chlorovodíkové (oxidační stav Cl + 5):
2HClOdva → HClO + HClO3
Kyselina chloritá se získává společně s kyselinou chlorovodíkovou při rozkladu vodného roztoku oxidu chloričitého.
Roztok kyseliny chlorité byl poprvé získán redukcí kyseliny chlorovodíkové kyselinou vinnou (A. J. Downs, 1973), avšak hlavním způsobem získání této kyseliny je zpracování suspenze chloridu barnatého kyselinou sírovou:
Ba (ClOdva)dva + HdvaSW4 → BaSO4 + 2HClOdva
Kyselina chlorovodíková je silné oxidační činidlo, i když její sklon k dismutaci nebo disproporci působí proti jejímu oxidačnímu potenciálu..
Chlor je jediný halogen, který tvoří izolovatelnou kyselinu vzorce HXOdva. Kyselina bromičitá ani kyselina jodová nebyly izolovány. Některé soli kyseliny bromité, bromitany, jsou známé, ale kromě meziproduktů při reakcích nejsou žádné soli jodičnanu..
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti
Když je kyselina chlorovodíková izolována, je to bezbarvá kapalina bez charakteristické vůně (National Center for Biotechnology Information, 2017).
Sloučenina má molekulovou hmotnost 68,456 g / mol. Má bod varu (vypočítaný) 502,07 ° C a rozpustnost ve vodě (vypočtený) 1 × 106 mg / l (Royal Society of Chemistry, 2015).
HClOdva je nestabilní v důsledku dismutační (nebo disproporcionační) reakce za vzniku kyseliny chlorové a chlorné (C. C. Hong, 1968) podobné analogickým kyselinám bromu a jodu:
2HClOdva → HClO + HClO3
Kyselina chlorovodíková je považována za slabou kyselinu, i když její disociační konstanta je řádově 1 x 10-dva což ho nezpůsobuje tak slabým účinkem jako jiné kyseliny s pKa 1,96.
Reaktivita a nebezpečí
Kyselina chlorovodíková je nestabilní sloučenina a silné oxidační činidlo nekompatibilní s redukčními činidly a zásadami..
Kyselina chlorovodíková dráždí při kontaktu s pokožkou a očima a je nebezpečná při požití a vdechování.
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem..
Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem..
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata.
Pokud postižený dýchá obtížně, měl by být podán kyslík. Pokud postižený nedýchá, provede se resuscitace z úst do úst. Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Při požití nevyvolávejte zvracení. Uvolněte těsné oblečení, jako jsou límce košile, opasky nebo kravaty. Pokud postižený nedýchá, proveďte resuscitaci z úst do úst. Ve všech případech okamžitě vyhledejte lékařskou pomoc..
Aplikace
Byly provedeny studie, kde se jako ústní voda pro redukci zubního plaku používají meta-stabilní roztoky kyseliny chlorité / oxidu chloričitého (Goultschin J, 1989).
Studie byla provedena na skupině 18 dobrovolníků ve věku 20-27 let. Byl testován jeho účinek na vývoj plaku a počet bakterií ve slinách, čímž se dosáhlo snížení až o 34,5% snížení skóre zubního plaku ve srovnání se skupinou s placebem.
Kyselina chlorovodíková se podílí na přípravě chloritanu sodného, který má antimikrobiální vlastnosti a je určen k použití především jako postřik nebo máčecí roztok pro drůbež, maso, zeleninu, ovoce a mořské plody. Používá se také v chladicí vodě pro drůbež.
Chloritan sodný se vyrábí přidáním potravinářské kyseliny (například kyseliny citrónové, kyseliny fosforečné, kyseliny chlorovodíkové, kyseliny jablečné nebo hydrogensíranu sodného) do vodného roztoku chloritanu sodného (NaClO)dva).
Kombinace kyseliny s roztokem chloritanu sodného vede k přeměně chloritanu na metastabilní kyselinu chloritou (HClOdva).
NaClOdva + H+ ⇌ HClOdva + Na+
Tento roztok může později vytvořit směs s chloritanem (ClOdva-), oxid chloričitý (ClOdva) a chlorid (Cl¯). Při reakci se vytvoří oxidativní roztok s oxychlorovanými druhy s antimikrobiálními vlastnostmi.
Chloritan sodný je určen k použití jako součást integrovaného přístupu určeného k řízení mikrobiální zátěže v potravinách.
Roztok chloritanu sodného působí na snížení počtu patogenů (například Escherichia coli, E. coli O157: H7, Salmonella spp., Campylobacter spp., A Listeria monocytogenes) (Rao, 2006).
Reference
- J. Downs, C. J. (1973). The Chemistry of Chlor, Bromine, Jod and Astatine: Pergamon…, Volume 7. New York: Pergamon press.
- C. Hong, W. H. (1968). Kinetika disproporcionace kyseliny chlorité. Canadian Journal of Chemistry 46 (12): , 2053-2060. nrcresearchpress.com.
- EMBL-EBI. (2014, 28. července). kyselina chloritá. Obnoveno z ChEBI: ebi.ac.uk.
- Goultschin J., G. J. (1989). Použití formulace metastabilizované kyseliny chlorité / chlordioxidu jako ústní vody pro redukci plaku. Isr J Dent Sci.2 (3), 142-147. ncbi.nlm.nih.gov.
- Národní centrum pro biotechnologické informace… (2017, 30. dubna). CID databáze PubChem Compound = 24453. Citováno z PubChem.
- Rao, M. V. (2006, prosinec). CHLORIT SODNÝ CHLORIT (ASC) Chemické a technické hodnocení. Obnoveno z fao.org.
- Royal Society of Chemistry. (2015). Kyselina chlorovodíková. Obnoveno z chemspider.com.



Zatím žádné komentáře