
Vzorec kyseliny chlorovodíkové (HClO3), vlastnosti, použití
The kyselina chlorovodíková je anorganická sloučenina vzorce HClO3, složený z kyseliny oxokyseliny, kde chlor má oxidační stav +5 se strukturou analogickou s kyselinou bromovou nebo jodovou. Je to silná kyselina schopná darovat vodík akceptoru nebo Bronstedově bázi..
Kyselina byla poprvé objevena v 17. století Johannem Rudolfem Glauberem z Karlstadt am Main v Německu, kde používal chlorid sodný a kyselinu sírovou k přípravě síranu sodného v Mannheimském procesu a uvolňoval chloridový plyn z vodíku, škodlivého pro člověka.
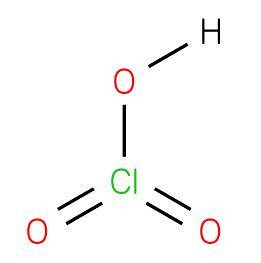
Sloučenina se získá chlorečnanem barnatým (chloritanem barytovým) s kyselinou sírovou za vzniku síranu barnatého (Jacob Green, 1829) nerozpustného ve vodě podle následující reakce:
Ba (ClO3)dva + HdvaSW4 → 2HClO3 + Baso4
Další způsob získávání je zahříváním kyseliny chlorné za získání kyseliny chlorovodíkové a chlorovodíku podle reakce:
3HClO → HClO3 + 2HCl
Kyselina chlorovodíková (HClO3) je silné oxidační činidlo, protože je schopné redukovat se na oxidační stavy +3, +1 a -1. Používá se k výrobě chlorečnanových solí.
Rozkládá se v koncentracích vyšších než 30%. Při zahřátí se také rozkládá, z tohoto důvodu musí být neustále udržován v chladu a všechny skleněné nádoby používané k manipulaci musí být předem chlazeny..
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 1.1 Samovolně reagující
- 2 Reaktivita a nebezpečí
- 3 použití
- 4 Odkazy
Fyzikální a chemické vlastnosti
Kyselina chlorová existuje pouze v roztoku. Je to bezbarvá kapalina bez charakteristické vůně (National Center for Biotechnology Information, 2017), její vzhled je znázorněn na obrázku 2.

Sloučenina má molekulovou hmotnost 84,459 g / mol a hustotu 1 g / ml při asi 25 ° C. Má bod varu vyšší než 100 ° C (CHLORIC ACID, S.F.) a rozpustnost ve vodě 40 g na 100 ml tohoto rozpouštědla při 25 ° C (Royal Society of Chemistry, 2015).
Kyselina chlorová urychlí spalování hořlavých materiálů a při kontaktu se může nejvíce vznítit. Sloučenina je korozivní pro kovy a tkaniny.
Samovolně reagující
- Koncentrace kyseliny chlorové nad 40% se rozpadají.
- Sulfid antimonitý a koncentrované roztoky kyseliny chlorovodíkové reagují se žhavením.
- Sulfid arsenitý a koncentrované roztoky kyseliny chlorovodíkové reagují se žhavením.
- Reaguje energicky, dokonce exploduje s jinými sulfidy kovů, tj. Sulfidem měďnatým.
- Při kontaktu s oxidovatelnými materiály, včetně amoniaku, mohou být reakce extrémně prudké..
- Po ponoření do kyseliny chlorovodíkové se filtrační papír rozsvítí.
- Výbuchy byly registrovány směsemi roztoku kyseliny chlorovodíkové s kovy, jako jsou: antimon, vizmut a železo. Je to způsobeno tvorbou výbušných sloučenin včetně vodíku (CHLORIC ACID, 2016).
Reaktivita a nebezpečí
Kyselina chlorová je nestabilní sloučenina. Jelikož je silnou kyselinou, je extrémně nebezpečný při kontaktu s pokožkou (je žíravý a dráždivý), při kontaktu s očima (dráždivý) a při požití. Také velmi nebezpečné v případě vdechování.
Silné nadměrné vystavení může způsobit poškození plic, udušení, ztrátu vědomí nebo smrt. Dlouhodobá expozice může způsobit popáleniny a ulcerace kůže.
Nadměrná expozice vdechováním může způsobit podráždění dýchacích cest. Zánět oka je charakterizován zarudnutím, slzením a svěděním. Zánět kůže je charakterizován svěděním, olupováním, zarudnutím a občasnými puchýři.
Látka je toxická pro ledviny, plíce a sliznice. Opakované nebo dlouhodobé vystavení látce může způsobit poškození těchto orgánů..
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem..
Kyselina může být také neutralizována zředěným hydroxidem sodným nebo slabou zásadou, jako je jedlá soda. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
Pokud je kontakt s pokožkou silný, měl by být omyt dezinfekčním mýdlem a kontaminovanou pokožku překrýt antibakteriálním krémem..
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru..
Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata. Pokud postižený dýchá obtížně, měl by být podán kyslík. Pokud postižený nedýchá, provede se resuscitace z úst do úst.
Vždy vezměte v úvahu, že pro osobu, která poskytuje pomoc při resuscitaci z úst do úst, může být nebezpečné, když je vdechovaný materiál toxický, infekční nebo žíravý.
Při požití nevyvolávejte zvracení. Uvolněte těsné oblečení, jako jsou límce košile, opasky nebo kravaty. Pokud postižený nedýchá, proveďte resuscitaci z úst do úst. Ve všech případech okamžitě vyhledejte lékařskou pomoc..
Aplikace
Kyselina chlorovodíková se používá hlavně k tvorbě chlorečnanových solí, jako jsou: chlorečnan sodný, vápenatý, hořečnatý, stroncium, olovo, měď a stříbro, jakož i chloristan a chloristan rtuťnatý se připravují za použití kyseliny chlorovodíkové jako činidla..
Stabilní prekurzor oxidu chloričitého, používá se při elektrochemické výrobě vysoce čistého chloristanu amonného (Dotson, 1993).
Hlavní výroba kyseliny chlorovodíkové byla zahájena během průmyslové revoluce v Evropě a byla použita k výrobě vinylchloridu pro PVC trubky.
Další použití pro kyselinu je řada aplikací v menším měřítku, včetně čištění domácnosti, výroby želatiny a dalších potravinářských přídatných látek, odstraňování vodního kamene a zpracování kůže (kyselina chlorovodíková, S.F.).
Reference
- KYSELINA CHLOROVÁ. (2016). Obnoveno z cameochemicals: cameochemicals.noaa.gov.
- kyselina chlorovodíková. (S.F.). Obnoveno z weebly: http://chloricacid.weebly.com/
- KYSELINA CHLOROVÁ. (S.F.). Obnoveno z chemické knihy: chemicalbook.com.
- Dotson, R. (1993). Nový elektrochemický proces výroby chloristanu amonného. Journal of Applied Electrochemistry, svazek 23, číslo 9,, 897-904. link.springer.com.
- EMBL-EBI. (2014, 28. července). kyselina chlorovodíková. Obnoveno z ebi.ac.uk: ebi.ac.uk.
- Jacob Green, E. T. (1829). Učebnice chemické filozofie . Philadelphia: Russell & Martien.
- Národní centrum pro biotechnologické informace… (2017, 15. dubna). Složená databáze PubChem; CID = 19654. Obnoveno z pubchem: .pubchem.ncbi.nlm.nih.gov.
- Royal Society of Chemistry. (2015). KYSELINA CHLOROVÁ. Obnoveno z chemspider: chemspider.com.


Zatím žádné komentáře