
Struktura, vlastnosti, syntéza a použití kyseliny dusičné (HNO3)
The kyselina dusičná Je to anorganická sloučenina sestávající z oxokyseliny dusíku. Je považována za silnou kyselinu, i když její pKa (-1,4) je podobný pKa hydroniového iontu (-1,74). Od tohoto okamžiku je možná „nejslabší“ z mnoha známých silných kyselin..
Jeho fyzický vzhled sestává z bezbarvé kapaliny, která se při skladování mění na nažloutlou barvu v důsledku tvorby dusíkatých plynů. Jeho chemický vzorec je HNO3.

Je poněkud nestabilní a podléhá mírnému rozkladu vystavenému slunečnímu záření. Kromě toho může být zcela rozložen zahřátím, čímž vznikne oxid dusičitý, voda a kyslík..
Obrázek výše ukazuje část kyseliny dusičné obsažené v odměrné baňce. Lze si všimnout jeho žlutého zbarvení, které svědčí o částečném rozkladu.
Používá se při výrobě anorganických a organických dusičnanů, jakož i nitrososloučenin, které se používají při výrobě hnojiv, výbušnin, meziproduktů pro barviva a různých organických chemických sloučenin..
Tato kyselina byla známa již alchymistům 8. století, kterým říkali „agua fortis“. Německý chemik Johan Rudolf Glauber (1648) navrhl způsob jeho přípravy, který spočíval v zahřívání dusičnanu draselného kyselinou sírovou.
Připravuje se průmyslově podle metody navržené Wilhelmem Oswaldem (1901). Metoda obecně spočívá v katalytické oxidaci amonného s postupným generováním oxidu dusnatého a oxidu dusičitého za vzniku kyseliny dusičné..
V atmosféře NEdva produkovaný lidskou činností reaguje s oblačnou vodou a tvoří HNO3. Pak se během kyselých dešťů sráží spolu s kapkami vody a sžírá například sochy na veřejných náměstích..
Kyselina dusičná je velmi toxická sloučenina a trvalé vystavení jejím výparům může vést k chronické bronchitidě a chemické pneumonii..
Rejstřík článků
- 1 Struktura kyseliny dusičné
- 1.1 Rezonanční struktury
- 2 Fyzikální a chemické vlastnosti
- 2.1 Chemické názvy
- 2.2 Molekulová hmotnost
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Bod varu
- 2.6 Teplota tání
- 2.7 Rozpustnost ve vodě
- 2.8 Hustota
- 2.9 Relativní hustota
- 2.10 Relativní hustota par
- 2.11 Tlak par
- 2.12 Rozklad
- 2.13 Viskozita
- 2.14 Koroze
- 2.15 Molární entalpie odpařování
- 2.16 Standardní molární entalpie
- 2.17 Standardní molární entropie
- 2.18 Povrchové napětí
- 2.19 Prahová hodnota zápachu
- 2.20 Disociační konstanta
- 2.21 Index lomu (η / D)
- 2.22 Chemické reakce
- 3 Syntéza
- 3.1 Průmyslové
- 3.2 V laboratoři
- 4 použití
- 4.1 Výroba hnojiv
- 4.2 Průmyslové
- 4.3 Čistička kovů
- 4.4 Aqua regia
- 4.5 Nábytek
- 4.6 Čištění
- 4.7 Fotografie
- 4.8 Ostatní
- 5 Toxicita
- 6 Reference
Struktura kyseliny dusičné
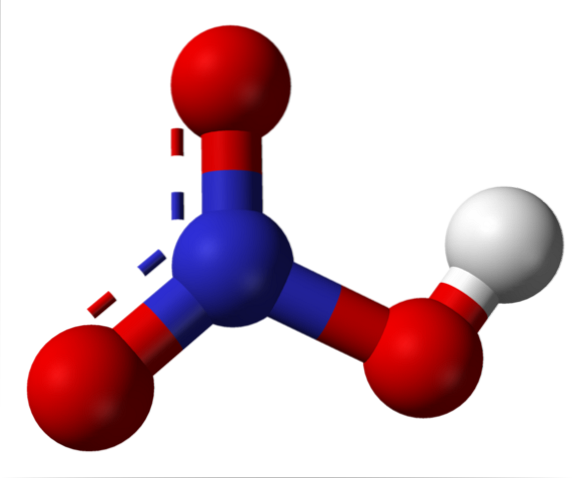
Horní obrázek ukazuje strukturu molekuly HNO.3 s modelem koulí a tyčí. Atom dusíku, modrá koule, je umístěn ve středu, obklopený geometrií trigonální roviny; trojúhelník je však zkreslený jedním ze svých nejdelších vrcholů.
Molekuly kyseliny dusičné jsou pak ploché. Vazby N = O, N-O a N-OH tvoří vrcholy plochého trojúhelníku. Pokud je pozorováno podrobně, vazba N-OH je protáhlejší než ostatní dvě (kde se nachází bílá koule představující atom H)..
Rezonanční struktury
Existují dvě vazby, které mají stejnou délku: N = O a N-O. Tato skutečnost je v rozporu s teorií valenčních vazeb, kde se předpokládá, že dvojné vazby budou kratší než jednoduché vazby. Vysvětlení spočívá ve fenoménu rezonance, jak je vidět na obrázku níže.

Obě vazby, N = O a N-O, jsou tedy ekvivalentní z hlediska rezonance. Toto je graficky znázorněno v modelu struktury pomocí přerušované čáry mezi dvěma atomy O (viz struktura).
Když je HNO deprotonován3, tvoří se stabilní dusičnan aniontu NO3-. V ní nyní rezonance zahrnuje všechny tři atomy O. To je důvod, proč HNO3 má vysokou kyselost Bronsted-Lowry (druhy H iontových dárců+).
Fyzikální a chemické vlastnosti
Chemické názvy
-Kyselina dusičná
-Kyselina azotová
-Dusičnan vodíku
-Fortis voda.
Molekulární váha
63,012 g / mol.
Fyzický vzhled
Bezbarvá nebo světle žlutá kapalina, která může mít červenohnědou barvu.
Zápach
Ostrá, dusivá charakteristika.
Bod varu
181 ° F až 760 mmHg (83 ° C).
Bod tání
-41,6 ° C.
Rozpustnost ve vodě
Velmi dobře rozpustný a mísitelný s vodou.
Hustota
1,513 g / cm3 při 20 ° C.
Relativní hustota
1,50 (ve vztahu k vodě = 1).
Relativní hustota par
2 nebo 3krát odhadované (ve vztahu k vzduchu = 1).
Tlak páry
63,1 mmHg při 25 ° C.
Rozklad
Při vystavení atmosférické vlhkosti nebo teplu se může rozložit na peroxid dusíku. Při zahřátí na rozklad vydává velmi toxický dým oxidu dusíku a dusičnanu..
Kyselina dusičná není stabilní, je schopna se rozkládat při kontaktu s teplem a vystavením slunečnímu záření a emituje oxid dusičitý, kyslík a vodu..
Viskozita
1092 mPa při 0 ° C a 0,617 mPa při 40 ° C.
Koroze
Je schopen napadnout všechny obecné kovy, kromě hliníku a chromové oceli. Napadá některé druhy plastů, pryží a povlaků. Je to žíravá a korozivní látka, proto s ní musí být zacházeno s maximální opatrností.
Molární entalpie odpařování
39,1 kJ / mol při 25 ° C.
Standardní molární entalpie
-207 kJ / mol (298 ° F).
Standardní molární entropie
146 kJ / mol (298 ° F).
Povrchové napětí
-0,04356 N / m při 0 ° C
-0,04 115 N / m při 20 ° C
-0,0376 N / m při 40 ° C
Prahová hodnota zápachu
-Nízký zápach: 0,75 mg / m3
-Vysoký zápach: 250 mg / m3
-Koncentrace dráždivých látek: 155 mg / m3.
Disociační konstanta
pKa = -1,38.
Index lomu (η / D)
1,393 (16,5 ° C).
Chemické reakce
Hydratace
-Může tvořit pevné hydráty, jako je HNO3∙ HdvaO a HNO3∙ 3HdvaNebo: „nitrický led“.
Disociace ve vodě
Kyselina dusičná je silná kyselina, která ve vodě rychle ionizuje následovně:
HNO3 (l) + HdvaO (l) => H3NEBO+ (ac) + NO3-
Tvorba solí
Reaguje s bazickými oxidy za vzniku dusičnanové soli a vody.
CaO (s) + 2 HNO3 (l) => Ca (Č3)dva (ac) + HdvaO (l)
Rovněž reaguje s bázemi (hydroxidy) a tvoří sůl dusičnanu a vody..
NaOH (vodný) + HNO3 (l) => NaNO3 (ac) + HdvaO (l)
A také s uhličitany a kyselými uhličitany (hydrogenuhličitany), které také tvoří oxid uhličitý.
NadvaCO3 (ac) + HNO3 (l) => NaNO3 (ac) + HdvaO (l) + COdva (G)
Protonace
Kyselina dusičná se může chovat také jako báze. Z tohoto důvodu může reagovat s kyselinou sírovou.
HNO3 + 2HdvaSW4 <=> NEdva+ + H3NEBO+ + 2HSO4-
Autoprotolýza
Kyselina dusičná prochází autoprotolýzou.
2HNO3 <=> NEdva+ + NE3- + HdvaNEBO
Oxidace kovů
Při reakci s kovy se kyselina dusičná nechová jako silné kyseliny, které reagují s kovy, tvoří odpovídající sůl a uvolňují vodík v plynné formě..
Hořčík a mangan však reagují za horka s kyselinou dusičnou, stejně jako ostatní silné kyseliny..
Mg (s) + 2 HNO3 (l) => Mg (č3)dva (ac) + Hdva (G)
jiný
Kyselina dusičná reaguje s siřičitany kovů za vzniku dusičnanové soli, oxidu siřičitého a vody..
NadvaSW3 (s) + 2 HNO3 (l) => 2 NaNO3 (ac) + SOdva (g) + HdvaO (l)
A také reaguje s organickými sloučeninami, přičemž nitroskupinu nahradí vodíkem; čímž tvoří základ pro syntézu výbušných sloučenin, jako je nitroglycerin a trinitrotoluen (TNT).
Syntéza
Průmyslový
Vyrábí se na průmyslové úrovni katalytickou oxidací amonia, podle metody popsané Oswaldem v roce 1901. Postup se skládá ze tří stupňů nebo kroků.
Fáze 1: Oxidace amonného na oxid dusnatý
Amoniak je oxidován kyslíkem ve vzduchu. Reakce se provádí při 800 ° C a při tlaku 6 až 7 atm za použití platiny jako katalyzátoru. Amoniak se mísí se vzduchem v následujícím poměru: 1 objem amoniaku na 8 objemů vzduchu.
4NH3 (g) +50dva (g) => 4NO (g) + 6HdvaO (l)
Při reakci se vyrábí oxid dusnatý, který se odvádí do oxidační komory pro další stupeň..
Fáze 2. Oxidace oxidu dusnatého na oxid dusičitý
Oxidace se provádí kyslíkem přítomným ve vzduchu při teplotě pod 100 ° C.
2NO (g) + Odva (g) => 2NOdva (G)
Fáze 3. Rozpouštění oxidu dusičitého ve vodě
V této fázi dochází k tvorbě kyseliny dusičné.
4NOdva + 2HdvaO + Odva => 4 HNO3
Existuje několik metod absorpce oxidu dusičitého (NOdva) ve vodě.
Mezi další metody: NEdva je dimerizován na NdvaNEBO4 při nízkých teplotách a vysokém tlaku, aby se zvýšila jeho rozpustnost ve vodě a vytvořila se kyselina dusičná.
3NdvaNEBO4 + 2HdvaO => 4HNO3 + 2NO
Kyselina dusičná vyrobená oxidací amoniaku má koncentraci mezi 50-70%, kterou lze zvýšit na 98% použitím koncentrované kyseliny sírové jako dehydratačního činidla, což umožňuje zvýšení koncentrace kyseliny dusičné..
V laboratoři
Tepelný rozklad dusičnanu měďnatého za vzniku oxidu dusičitého a kyslíkových plynů, které procházejí vodou za vzniku kyseliny dusičné; jako v dříve popsané Oswaldově metodě.
2Cu (č3)dva => 2CuO + 4NOdva + NEBOdva
Reakce dusičnanové soli s HdvaSW4 koncentrovaný. Vytvořená kyselina dusičná se oddělí od HdvaSW4 destilací při 83 ° C (bod varu kyseliny dusičné).
KNO3 + HdvaSW4 => HNO3 + KHSO4
Aplikace
Výroba hnojiv
60% výroby kyseliny dusičné se používá při výrobě hnojiv, zejména dusičnanu amonného.
To se vyznačuje vysokou koncentrací dusíku, jedné ze tří hlavních rostlinných živin, přičemž dusičnany rostliny okamžitě využívají. Amoniak se mezitím oxiduje mikroorganismy přítomnými v půdě a používá se jako dlouhodobé hnojivo..
Průmyslový
-15% výroby kyseliny dusičné se používá při výrobě syntetických vláken.
-Používá se při výrobě esterů kyseliny dusičné a nitroderivátů; jako je nitrocelulóza, akrylové barvy, nitrobenzen, nitrotoluen, akrylonitrily atd..
-Může přidávat nitroskupiny k organickým sloučeninám a tuto vlastnost lze použít k výrobě výbušnin, jako je nitroglycerin a trinitrotoluen (TNT)..
-Kyselina adipová, prekurzor nylonu, se vyrábí ve velkém měřítku oxidací cyklohexanonu a cyklohexanolu kyselinou dusičnou..
Čistička kovů
Kyselina dusičná je díky své oxidační schopnosti velmi užitečná při čištění kovů přítomných v minerálech. Podobně se používá při získávání prvků, jako je uran, mangan, niob, zirkon, a při okyselování fosforečných hornin za účelem získání kyseliny fosforečné..
Královská voda
Smísí se s koncentrovanou kyselinou chlorovodíkovou za vzniku „aqua regia“. Toto řešení je schopné rozpouštět zlato a platinu, což umožňuje jeho použití při čištění těchto kovů..
Nábytek
Kyselina dusičná se používá k dosažení starožitného účinku u nábytku vyrobeného z borového dřeva. Ošetření 10% roztokem kyseliny dusičné produkuje šedo-zlaté zabarvení dřeva nábytku.
Čištění
-Směs vodných roztoků kyseliny dusičné 5-30% a kyseliny fosforečné 15-40% se používá k čištění zařízení používaných při dojení, aby se odstranily zbytky sraženin sloučenin hořčíku a vápníku.
-To je užitečné při čištění skleněného zboží používaného v laboratoři.
Fotografování
-Kyselina dusičná se používá ve fotografii, konkrétně jako přísada do vývojek síranu železnatého v procesu mokré desky, aby se podpořilo bělejší zbarvení ambrotypů a tintypů..
-Používal se ke snížení pH stříbrné lázně kolodiových desek, což umožnilo dosáhnout snížení vzhledu mlhy, která interferovala s obrazy.
Ostatní
-Vzhledem ke své kapacitě rozpouštědel se používá při analýze různých kovů technikami atomové absorpční plamene plamenem a hmotnostní spektrofotometrií s indukčně vázanou plazmou..
-Kombinace kyseliny dusičné a kyseliny sírové byla použita pro přeměnu běžné bavlny na dusičnan celulózy (dusičná bavlna).
-Lék Salcoderm pro vnější použití se používá k léčbě benigních novotvarů kůže (bradavice, kuří oka, kondylomy a papilomy). Má vlastnosti kauterizace, zmírnění bolesti, podráždění a svědění. Kyselina dusičná je hlavní složkou lékové formy.
-Červená dýmavá kyselina dusičná a bílá dýmavá kyselina dusičná se používají jako oxidanty pro kapalná raketová paliva, zejména v raketě BOMARC..
Toxicita
-Při kontaktu s pokožkou může způsobit popáleniny, silné bolesti a dermatitidu..
-Při kontaktu s očima může způsobit silnou bolest, slzení a ve vážných případech poškození rohovky a slepotu..
-Vdechování par může při těžkých nebo chronických expozicích způsobit kašel, dýchací potíže, krvácení z nosu, laryngitidu, chronickou bronchitidu, pneumonii a plicní edém..
-Kvůli jeho požití dochází k lézím v ústech, slinění, intenzivní žízeň, bolest při polykání, intenzivní bolest v zažívacím traktu a riziko perforace její stěny..
Reference
- Wikipedia. (2018). Kyselina dusičná. Obnoveno z: en.wikipedia.org
- PubChem. (2018). Kyselina dusičná. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Redaktoři Encyclopaedia Britannica. (23. listopadu 2018). Kyselina dusičná. Encyklopedie Britannica. Obnoveno z: britannica.com
- Shrestha B. (s.f.). Vlastnosti kyseliny dusičné a použití. Průvodce chemem: výukové programy pro studium chemie. Obnoveno z: chem-guide.blogspot.com
- Chemická kniha. (2017). Kyselina dusičná. Obnoveno z: chemicalbook.com
- Imanol. (10. září 2013). Výroba kyseliny dusičné. Obnoveno z: ingenieriaquimica.net


Zatím žádné komentáře