
Co je to zředěný roztok? faktory a příklady
A zředěný roztok nebo nenasycenéJedná se o chemický roztok, který nedosáhl maximální koncentrace rozpuštěné látky rozpuštěné v rozpouštědle. Další rozpuštěná látka se po přidání do zředěného roztoku rozpustí a ve vodné fázi se neobjeví..
Z fyzikálně-chemického hlediska je nenasycený roztok považován za stav dynamické rovnováhy, kde rychlosti, při kterých rozpouštědlo rozpouští rozpuštěnou látku, jsou větší než rychlost rekrystalizace..
Příklad zředěného roztoku je znázorněn na obrázku 1. Na obrázcích 1.1, 1.2 a 1.3 je v kádince konstantní objem vody.
Na obrázku 1.1 proces začíná tam, kde se rozpuštěná látka začíná rozpouštět, což je znázorněno červenými šipkami. V tomto případě jsou vidět dvě fáze, kapalina a pevná látka.
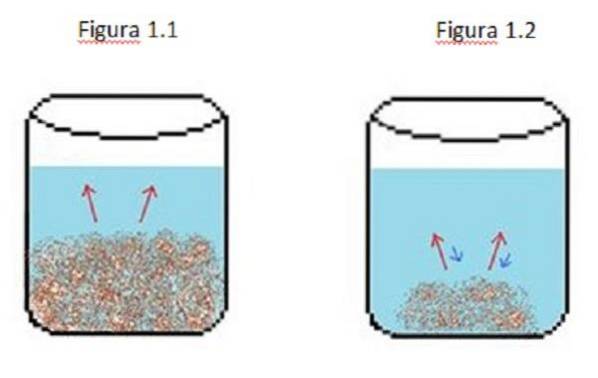
Na obrázku 1.2 se velká část pevné látky rozpustila, ale ne úplně kvůli rekrystalizačnímu procesu, představovanému modrými šipkami..
V tomto případě jsou červené šipky větší než modré šipky, což znamená, že rychlost ředění je větší než rychlost rekrystalizace. V tomto okamžiku máte nenasycené řešení.
Můžeme tedy říci, že zředěný roztok v něm může rozpouštět více rozpuštěných látek, dokud nedosáhne bodu nasycení. V bodě nasycení se již žádná rozpuštěná látka v rozpouštědle nerozpouští a takové řešení se nazývá nasycený roztok..
Tímto způsobem jsou roztoky zpočátku nenasycené povahy a nakonec se stanou nasycenými roztoky přidáním rozpuštěné látky..
Co je to zředěný roztok?
Zředěný roztok je ten nenasycený, nasycený nebo přesycený, do kterého se přidá více rozpouštědla. Výsledkem je nenasycený roztok nižší koncentrace.
Ředění je v chemické laboratoři běžným procesem. Obecně pracujete se zředěnými řešeními, která jsou vyráběna ze zásobních řešení, která jsou nakupována přímo od konkrétního obchodníka.
Pro přípravu ředění se používá vzorec C.1PROTI1= C.dvaPROTIdva kde C je koncentrace roztoku, obecně pokud jde o molaritu nebo normálnost. V je objem roztoku v ml a členy 1 a 2 odpovídají koncentrovaným a zředěným roztokům.
Faktory ovlivňující rozpustnost
Množství rozpuštěné látky, která může být rozpuštěna v rozpouštědle, bude záviset na různých faktorech, z nichž nejdůležitější jsou:
1- Teplota
Rozpustnost se zvyšuje s teplotou. Například v horké vodě lze rozpustit více soli než ve studené vodě..
Mohou však existovat výjimky, například rozpustnost plynů ve vodě klesá s rostoucí teplotou..
V tomto případě molekuly rozpuštěné látky dostávají při zahřívání kinetickou energii, což usnadňuje jejich únik..
2 - Tlak
Zvýšený tlak může vynutit rozpuštění solutů. To se běžně používá k rozpouštění plynů v kapalinách..
3 - Chemické složení
Rozpustnost ovlivňuje povaha rozpuštěné látky a rozpouštědla a přítomnost dalších chemických sloučenin v roztoku..
Například ve vodě lze rozpustit více cukru než soli ve vodě. V tomto případě se říká, že cukr je rozpustnější.
Ethanol a voda jsou navzájem zcela rozpustné. V tomto konkrétním případě bude rozpouštědlem sloučenina nalezená v největším množství.
4 - Mechanické faktory
Na rozdíl od rychlosti rozpouštění, která závisí hlavně na teplotě, rychlost rekrystalizace závisí na koncentraci rozpuštěné látky na povrchu krystalové mřížky, která je upřednostňována, když je roztok nepohyblivý.
Proto míchání roztoku zabraňuje této akumulaci a maximalizuje rozpuštění..
Křivky sytosti a rozpustnosti
Křivky rozpustnosti jsou grafickou databází, kde se porovnává množství rozpuštěné látky v množství rozpouštědla při určité teplotě.
Křivky rozpustnosti se běžně vykreslují pro množství rozpuštěné látky, buď pevné látky nebo plynu, ve 100 gramech vody. Křivky sytosti pro různé rozpuštěné látky ve vodě jsou znázorněny na obrázku 2..
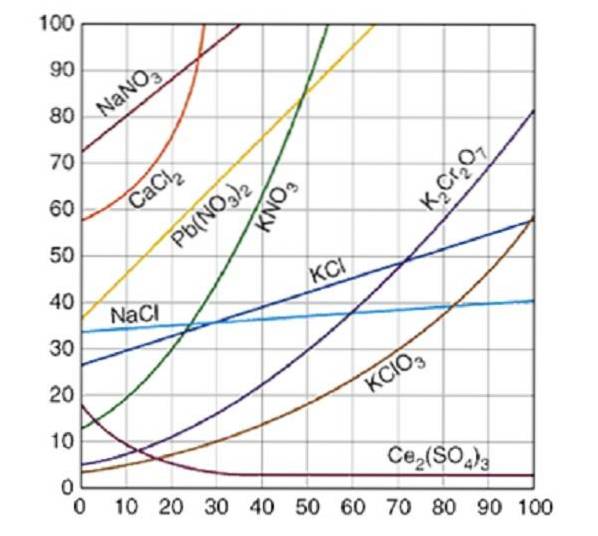
Křivka ukazuje bod nasycení při dané teplotě. Oblast pod křivkou naznačuje, že máte nenasycené řešení, a proto lze přidat více rozpuštěné látky. V oblasti nad křivkou je přesycené řešení.
Vezmeme-li jako příklad chlorid sodný (NaCl), při 25 stupních Celsia lze přibližně 35 gramů NaCl rozpustit ve 100 gramech vody za získání nasyceného roztoku.
Příklady zředěných roztoků
Nenasycené roztoky lze nalézt denně, není nutné být v chemické laboratoři.
Rozpouštědlem nemusí být nutně voda. Níže uvádíme každodenní příklady zředěných řešení:
- Přidáním lžíce cukru do šálku horké kávy vznikne roztok nenasyceného cukru.
- Ocet je zředěný roztok kyseliny octové ve vodě.
- Mlha je nenasycený (ale téměř nasycený) roztok vodní páry ve vzduchu.
- 0,01 M HCl je nenasycený roztok kyseliny chlorovodíkové ve vodě.
- Třecí alkohol je zředěný roztok isopropylalkoholu ve vodě.
- Polévka je nenasycený roztok vody a chloridu sodného.
- Alkoholické nápoje jsou zředěné roztoky ethanolu a vody. Obvykle se zobrazuje procento alkoholu, které mají.
Reference
- Anne Marie Helmenstine, P. (2016, 7. července). Definice a příklady nasyceného řešení. Obnoveno z about.com.
- Cambrige University. (s.f.). Křivky rozpustnosti. Obnoveno z dynamicscience.com.au.
- Příklady nasyceného řešení. (s.f.). Obnoveno z examples.yourdcitionary.com.
- J., S. (2014, 4. června). Nasycená a přesycená řešení. Obnoveno ze socratic.org.
- James, N. (s.f.). Nasycené řešení: Definice a příklady. Obnoveno ze studie.com.
- M., B. (2014, 14. října). Nasycená a přesycená řešení. Obnoveno ze socratic.org.
- Křivky rozpustnosti. (s.f.). Obnoveno z kentchemistry.com.
- Tipy pro sytost. (2014, 26. června). Obnoveno z chem.libretexts.org.



Zatím žádné komentáře