
Struktura kyseliny jantarové, vlastnosti, výroba, použití
The kyselina jantarová je pevná organická sloučenina, jejíž chemický vzorec je C4H6NEBO4. Jedná se o dikarboxylovou kyselinu, to znamená, že má dvě karboxylové skupiny -COOH, jednu na každém konci molekuly, jejíž kostra má 4 atomy uhlíku. Je také známá jako kyselina butandiová. Říká se, že je to alfa, omega-dikarboxylová kyselina nebo C4-dikarboxylová kyselina.
Je široce distribuován v rostlinách, houbách a zvířatech. Jeho sukcinátový anion je základní součástí Krebsova cyklu, který se skládá z řady chemických reakcí, ke kterým dochází během buněčného dýchání..

Kyselina jantarová je jednou z přírodních kyselin obsažených v potravinách, v ovoci, jako jsou hrozny a meruňky, v zelenině, jako je brokolice a řepa, sýrech a masu..
Vyskytuje se také ve žlutém nebo sukcino jantaru, z něhož pochází i jeho název. Lze jej získat destilací této nebo jiných pryskyřic. Průmyslově se získává hydrogenací kyseliny maleinové.
Kyselina jantarová se také vytváří při fermentaci vína. Kromě toho se jedná o vysoce ceněné přírodní aroma pro různé potraviny. Používá se také jako surovina k získávání různých chemických sloučenin, které mají uplatnění v různých průmyslových oblastech, v medicíně a kosmetice..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Bod vzplanutí
- 3.6 Specifická hmotnost
- 3.7 Index lomu
- 3.8 Rozpustnost
- 3,9 pH
- 3.10 Disociační konstanty
- 3.11 Chemické vlastnosti
- 3.12 Chemické reakce průmyslového významu
- 4 Získání
- 5 použití
- 5.1 V potravinářském průmyslu
- 5.2 Ve vinařském průmyslu
- 5.3 Při výrobě dalších chemických sloučenin
- 5.4 V různých aplikacích
- 6 Reference
Struktura
Kyselina jantarová má 4 atomy uhlíku spojené lineárně, ale klikatě. Je to jako molekula butanu, ve které jsou methylové skupiny -CH3 jsou oxidovány za vzniku karboxylových skupin -COOH.
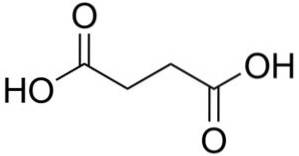
Nomenklatura
- Kyselina jantarová
- Kyselina butandiová
- Kyselina 1,4-butandiová
- 1,2-etandikarboxylová kyselina
- Jantarová kyselina
- Jantarový duch
Vlastnosti
Fyzický stav
Bezbarvá až bílá krystalická pevná látka, triclinické krystaly nebo monoklinické hranoly
Molekulární váha
118,09 g / mol
Bod tání
188,0 ° C
Bod varu
235 ° C
Bod vzplanutí
160 ° C (metoda otevřeného kelímku).
Specifická hmotnost
1 572 při 25 ° C / 4 ° C
Index lomu
1450
Rozpustnost
Ve vodě: 83,2 g / l při 25 ° C.
Rozpustný v ethanolu CH3CHdvaOH, ethylether (CH3CHdva)dvaNebo aceton CH3Auto3 a methanol CH3ACH. Nerozpustný v toluenu a benzenu.
pH
0,1 molární (0,1 mol / l) vodný roztok má pH 2,7.
Disociační konstanty
K.1 = 6,4 x 10-5
K.dva = 0,23 x 10-5
Chemické vlastnosti
Dikarboxylové kyseliny obecně vykazují stejné chemické chování jako monokarboxylové kyseliny. Kyselinový charakter dikarboxylové kyseliny je však větší než u monokarboxylové kyseliny.
Pokud jde o ionizaci jejích vodíků, dochází k ionizaci druhé karboxylové skupiny méně snadno než u první, jak je vidět na disociačních konstantách kyseliny jantarové, kde K1 je větší než K.dva.
Rozpouští se ve vodném NaOH a NaHCO3 vodný.
Kyselina jantarová není hygroskopická.
Při zahřátí velmi snadno uvolňuje molekulu vody a tvoří anhydrid kyseliny jantarové..
Chemické reakce průmyslového významu
Redukční reakcí (opak oxidace) se kyselina jantarová převádí na 1,4-butandiol.
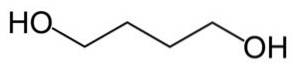
Dehydrogenací 1,4-butandiolu (eliminace vodíku) se získá y-butyrolakton.
Když se 1,4-butandiol cyklizuje (tvorba cyklické molekuly), získá se tetrahydrofuran.
Aminací kyseliny jantarové (přídavkem aminu) se získají pyrrolidony.
Jeho polymerace s dioly umožňuje získat polyestery a s diaminy se získají polyamidy. Oba jsou široce používané polymery.
Získávání
Množství přítomné v přírodních zdrojích je velmi malé, takže se průmyslově získává syntézou z jiných sloučenin obecně odvozených z ropy..
Může být vyroben katalytickou hydrogenací kyseliny maleinové nebo anhydridu kyseliny maleinové.
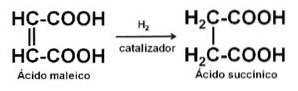
Také z kyseliny fumarové nebo z acetylenu a formaldehydu.
To vše jsou však petrochemické procesy znečišťující životní prostředí a závislé na ceně ropy. Z těchto důvodů se již dlouho vyvíjejí další výrobní metody založené na anaerobní fermentaci, které jsou levnější a méně znečišťují..
Tyto procesy používají COdva, co je prospěšné pro snížení tohoto plynu a skleníkový efekt, který vytváří.
Jeho výroba může být fermentační, například s Anaerobiospirillum succiniproducens Y Actinobacillus succinogenes, které ho produkují ve vysokých koncentracích ze zdrojů uhlíku, jako je glukóza, laktóza, xylóza, arabinóza, celobióza a další cukry. Používají také COdva jako zdroj uhlíku.
Existují vědci, kteří podporují rozvoj koncepce biorafinérií, která by umožnila plně využít potenciál obnovitelných zdrojů. Tak je tomu v případě použití odpadních vod z výroby papíru, kukuřičných stonků, biomasy z řas, bagasy z cukrové třtiny, třtinové melasy, odpadu ze stonků plodin a řepné dřeně k získání kyseliny jantarové, cenných produktů..

Například použití řepné buničiny zahrnuje extrakci pektinu a části bohaté na fenolické antioxidanty, následovanou hydrolýzou celulózy a hemicelulózy za získání fermentovatelných cukrů. Posledně uvedené jsou základem pro získání kyseliny jantarové její anaerobní fermentací v bioreaktorech..
Aplikace
V potravinářském průmyslu
Kyselina jantarová přirozeně dodává jídlu chuť. Má účinek zvýrazňující chuť, proto se používá jako přísada do zpracovaných potravin.
Bylo navrženo, že má účinky na příchutě, které nelze duplikovat jinými kyselinami v potravinách, jako je například takzvaná umami příchuť v některých sýrech (umami je japonské slovo, které znamená „chutné“)..

Pro svou stimulaci se dokonce používá v krmivech pro zvířata.
Ve vinařském průmyslu
Kyselina jantarová se přirozeně vyskytuje při alkoholickém kvašení vína. Z netěkavých kyselin, které se v tomto procesu vytvářejí, odpovídá kyselina jantarová 90% z celkového počtu..

Víno obsahuje přibližně 0,5 až 1,5 g / l kyseliny jantarové, která může dosáhnout 3 g / l.
Při výrobě dalších chemických sloučenin
Kyselina jantarová je surovina pro získávání produktů vysoké průmyslové hodnoty, jako je tetrahydrofuran, 1,4-butandiol, gama-butyrolakton, kyselina adipová, lineární alifatické estery, N-methylpyrrolidon a biologicky odbouratelné polymery..
Tyto sloučeniny a materiály mají četné aplikace v plastikářském průmyslu (elastická vlákna, elastické filmy), lepidlech, průmyslových rozpouštědlech (odstraňování barev a laků), čisticích prostředcích v mikroelektronice, medicíně (anestetika, léky), zemědělství, textilu a kosmetice..
V různých aplikacích
Kyselina jantarová je složkou některých farmaceutických přípravků. Sukcinimidy odvozené od kyseliny jantarové se v medicíně používají jako antikonvulziva.
Je součástí receptur inhibitorů koroze, slouží jako změkčovadlo polymerů a používá se v parfumérii. Je také meziproduktem při syntéze povrchově aktivních látek a detergentů.
Kyselinu jantarovou lze použít jako monomer pro výrobu biologicky odbouratelných polymerů a plastů.
Používá se v zemědělských vzorcích pro pěstování plantáží.
Soli kyseliny jantarové se používají v chladicích prostředcích pro nosiče a pro podporu odmrazování, protože jsou méně znečišťující než jiné sloučeniny.
Estery sukcinátu se používají jako přísady do paliv.
Reference
- NÁS. Národní lékařská knihovna. (2019). Kyselina jantarová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Comuzzo, P. a Battistutta, F. (2019). Okyselení a kontrola pH v červených vínech. V technologii červeného vína. Obnoveno ze sciencedirect.com.
- Alexandri, M. a kol. (2019). Restrukturalizace konvenčního průmyslu cukrovky na novou biorafinérii: Frakcionace a biokonverze buničiny cukrové řepy na kyselinu jantarovou a vedlejší produkty s přidanou hodnotou. ACS Sustainable Chemistry & Engineering. Únor 2019. Obnoveno z pubs.acs.org.
- Methven, L. (2012). Přírodní zvýrazňovač chutí potravin a nápojů. V přírodních potravinářských přídatných látkách, přísadách a příchutích. Obnoveno ze sciencedirect.com.
- Featherstone, S. (2015). Složky používané při přípravě konzervovaných potravin. V úplném kurzu konzervování a souvisejících procesů (čtrnácté vydání). Obnoveno ze sciencedirect.com.
- Qureshi, N. (2009). Přínosné biofilmy: odpadní voda a další průmyslové aplikace. V biofilmech v potravinářském a nápojovém průmyslu. Obnoveno ze sciencedirect.com.


Zatím žádné komentáře