
Vznik, vlastnosti a aplikace diazoniových solí
The diazoniové soli jsou organické sloučeniny, ve kterých dochází k iontovým interakcím mezi azo skupinou (-Ndva+) a anion X- (Cl-, F-, CH3VRKAT-, atd.). Jeho obecný chemický vzorec je RNdva+X-, a v tomto postranním řetězci R může být alifatická skupina nebo arylová skupina; tj. aromatický kruh.
Dolní obrázek představuje strukturu arenediazoniového iontu. Modré koule odpovídají azoskupině, zatímco černé a bílé koule tvoří aromatický kruh fenylové skupiny. Azo skupina je velmi nestabilní a reaktivní, protože jeden z atomů dusíku má kladný náboj (-N+≡N).
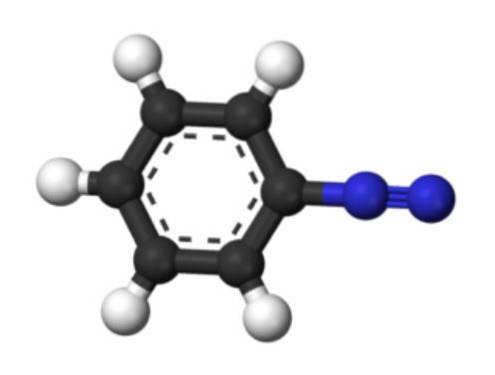
Existují však rezonanční struktury, které delokalizují tento kladný náboj, například na sousedním atomu dusíku: -N = N+. Vzniká, když pár elektronů tvořících vazbu jde k atomu dusíku nalevo.
Podobně je tento kladný náboj schopen delokalizovat systémem Pi aromatického kruhu. V důsledku toho jsou aromatické diazoniové soli stabilnější než alifatické, protože pozitivní náboj nelze delokalizovat podél uhlíkového řetězce (CH3, CHdvaCH3, atd.).
Rejstřík článků
- 1 Školení
- 2 Vlastnosti
- 2.1 Reakce posunutí
- 2.2 Další posunutí
- 2.3 Redoxní reakce
- 2.4 Fotochemický rozklad
- 2.5 Azo vazebné reakce
- 3 Aplikace
- 4 Odkazy
Výcvik
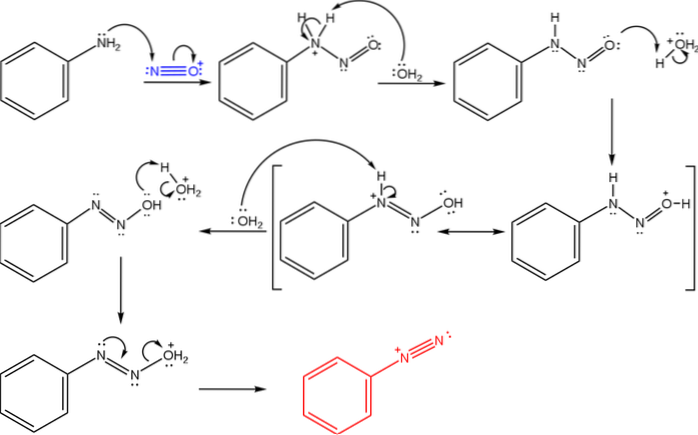
Tyto soli jsou odvozeny z reakce primárního aminu s kyselou směsí dusitanu sodného (NaNOdva).
Sekundární aminy (R.dvaNH) a terciární (R3N) vznikají jiné dusíkaté produkty, jako jsou N-nitrosoaminy (což jsou nažloutlé oleje), aminové soli (R3HN+X-) a N-nitrosoamonné sloučeniny.
Horní obrázek ilustruje mechanismus, kterým se řídí tvorba diazoniových solí, nebo také známý jako diazotační reakce.
Reakce začíná fenylaminem (Ar-NHdva), který provádí nukleofilní útok na atom N nitrosoniového kationtu (NO+). Tento kation je produkován směsí NaNOdva/ HX, kde X je obecně Cl; tj. HCl.
Tvorba nitrosoniového kationu uvolňuje vodu do média, které odstraňuje proton z pozitivně nabitého dusíku..
Pak tato stejná molekula vody (nebo jiný kyselý druh než H3NEBO+) poskytuje proton kyslíku a delokalizuje kladný náboj na méně elektronegativním atomu dusíku).
Nyní voda opět deprotonuje dusík a produkuje tak molekulu diazohydroxidu (předposlední v pořadí).
Protože médium je kyselé, diazohydroxid podléhá dehydrataci z OH skupiny; k vyrovnání elektronického volného místa tvoří volný pár N trojnou vazbu azo skupiny.
Na konci mechanismu tedy benzendiazoniumchlorid (C6H5Ndva+Cl-, stejný kation z prvního obrázku).
Vlastnosti
Obecně jsou diazoniové soli bezbarvé a krystalické, rozpustné a stabilní při nízkých teplotách (méně než 5 ° C)..
Některé z těchto solí jsou tak citlivé na mechanické nárazy, že by je mohla odpálit jakákoli fyzická manipulace. Nakonec reagují s vodou za vzniku fenolů.
Reakce posunutí
Diazoniové soli jsou potenciálními uvolňovači molekulárního dusíku, jehož tvorba je společným jmenovatelem při vytěsňovacích reakcích. V nich druh X vytlačuje nestabilní azoskupinu a uniká jako Ndva(G).
Sandmeyerova reakce
ArNdva+ + CuCl => ArCl + Ndva + Cu+
ArNdva+ + CuCN => ArCN + Ndva + Cu+
Gattermanova reakce
ArNdva+ + CuX => ArX + Ndva + Cu+
Na rozdíl od Sandmeyerovy reakce má Gattermanova reakce místo své halogenidy kovovou měď; to znamená, že je generován CuX in situ.
Schiemannova reakce
[ArNdva+] BF4- => ArF + BF3 + Ndva
Schiemannova reakce je charakterizována tepelným rozkladem benzendiazonium-fluorborátu.
Gomberg Bachmann reakce
[ArNdva+] Cl- + C6H6 => Ar - C6H5 + Ndva + HCl
Další posunutí
ArNdva+ + KI => ArI + K.+ + Ndva
[ArNdva+] Cl- + H3POdva + HdvaO => C.6H6 + Ndva + H3PO3 + HCl
ArNdva+ + HdvaO => ArOH + Ndva + H+
ArNdva+ + Razítkodva => ArNOdva + Ndva + Cu+
Redoxní reakce
Diazoniové soli lze redukovat na arylhydraziny pomocí směsi SnCldva/ HCl:
ArNdva+ => ArNHNHdva
Mohou být také redukovány na arylaminy v silnějších redukcích pomocí Zn / HCl:
ArNdva+ => ArNHdva + NH4Cl
Fotochemický rozklad
[ArNdva+] X- => ArX + Ndva
Diazoniové soli jsou citlivé na rozklad rozkladem ultrafialového záření nebo při velmi blízkých vlnových délkách.
Azo vazebné reakce
ArNdva+ + Ar'H → ArNdvaAr '+ H+
Tyto reakce jsou možná nejužitečnější a nejuniverzálnější z diazoniových solí. Tyto soli jsou slabé elektrofily (kruh delokalizuje kladný náboj azoskupiny). Aby mohly reagovat s aromatickými sloučeninami, musí být negativně nabité, což vede ke vzniku azosloučenin..
Reakce probíhá s účinným výtěžkem mezi pH 5 a 7. V kyselém pH je vazba nižší, protože azo skupina je protonována, což znemožňuje útok na negativní kruh..
Podobně při bazickém pH (vyšším než 10) reaguje diazoniová sůl s OH- k výrobě diazohydroxidu, který je relativně inertní.
Struktury tohoto typu organické sloučeniny mají velmi stabilní konjugovaný Pi systém, jehož elektrony absorbují a emitují záření ve viditelném spektru..
V důsledku toho se azosloučeniny vyznačují barevností. Díky této vlastnosti se jim také říkalo azobarviva.
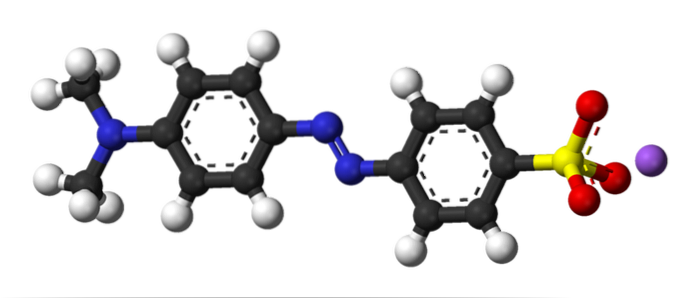
Obrázek nahoře ilustruje koncept azo vazby s methyloranžovou jako příklad. Uprostřed své struktury lze azo skupinu vidět jako spojku dvou aromatických kruhů.
Který z těchto dvou kruhů byl elektrofilem na začátku vazby? Ten vpravo, protože sulfonátová skupina (-SO3) odstraňuje hustotu elektronů z kruhu, čímž je ještě více elektrofilní.
Aplikace

Jednou z jeho nejkomerčnějších aplikací je výroba barviv a pigmentů, která zahrnuje i textilní průmysl v barvení tkanin. Tyto azosloučeniny kotví na specifických molekulárních místech na polymeru a zabarvují jej.
Díky svému fotolytickému rozkladu se (méně než dříve) používá při reprodukci dokumentů. Jak? Plochy papíru pokryté speciálním plastem se odstraní a poté se na ně nanese základní roztok fenolu, který zbarví písmena nebo vzor modře..
V organických syntézách se používají jako výchozí body pro mnoho aromatických derivátů.
Konečně mají aplikace v oblasti inteligentních materiálů. V nich jsou kovalentně vázány na povrch (například zlato), což mu umožňuje chemicky reagovat na vnější fyzikální podněty..
Reference
- Wikipedia. (2018). Diazoniová sloučenina. Citováno dne 25. dubna 2018 z: en.wikipedia.org
- Francis A. Carey. Organická chemie. Karboxylové kyseliny. (šesté vydání, strany 951-959). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. Organická chemie. Miny. (10. vydání., Strany 935-940). Wiley plus.
- Clark J. (2016). Reakce diazoniových solí. Citováno dne 25. dubna 2018 z: chemguide.co.uk
- BYJU'S. (5. října 2016). Diazoniové soli a jejich aplikace. Citováno dne 25. dubna 2018, z: byjus.com
- TheGlobalTutors. (2008-2015). Vlastnosti diazoniových solí. Citováno dne 25. dubna 2018 z: theglobaltutors.com
- Ahmad et al. (2015). Polymer. Citováno dne 25. dubna 2018, z: msc.univ-paris-diderot.fr
- CytochromeT. (15. dubna 2017). Mechanismus vzniku benzendiazoniového iontu. Citováno dne 25. dubna 2018 z webu: commons.wikimedia.org
- Jacques Kagan. (1993). Organická fotochemie: principy a aplikace. Academic Press Limited, strana 71. Citováno dne 25. dubna 2018, z: books.google.co.ve



Zatím žádné komentáře