
Chemická struktura, vlastnosti a použití síranu amonného

The síran amonný Je to ternární amoniakální anorganická sůl kyseliny sírové. Jeho chemický vzorec je (NH4)dvaSW4. Stochiometrické proporce proto říkají, že pro každý síranový anion existují dva amonné kationty, které s ním interagují. To umožňuje neutralitu soli (((+1) ∙ 2 + (-2)).
Jeho nomenklatura je způsobena skutečností, že jde o sůl odvozenou od HdvaSW4, změna přípony „uric“ na „ato“. Dva počáteční protony jsou tedy nahrazeny NH4+, produkt reakce s amoniakem (NH3). Chemická rovnice pro jeho syntézu je tedy: 2 NH3 + HdvaSW4 => (NH4)dvaSW4
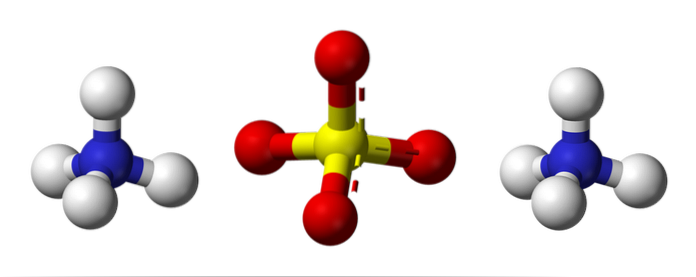
Síran amonný je pufr dusíku a síry, který je nezbytný pro chemii půdy a hnojiva..
Rejstřík článků
- 1 Chemická struktura
- 2 Fyzikální a chemické vlastnosti
- 2.1 Molekulová hmotnost
- 2.2 Fyzický vzhled
- 2.3 Zápach
- 2.4 Teplota tání
- 2.5 Rozpustnost
- 2.6 Hustota
- 2.7 Tlak par
- 2.8 Bod vzplanutí
- 2,9 pH
- 2.10 Stabilita
- 2.11 Rozklad
- 2.12 Koroze
- 3 použití
- 3.1 V zemědělství
- 3.2 Jako analytické činidlo
- 3.3 Při srážení a izolaci bílkovin
- 3.4 V průmyslu
- 3.5 Jiná použití
- 4 Odkazy
Chemická struktura
Horní obrázek ilustruje molekulární geometrii NH iontů4+ A tak4dva-. Červené koule odpovídají atomům kyslíku, bílé koule atomům vodíku, modrá atomu dusíku a žlutá atomu síry.
Oba ionty lze považovat za dva čtyřstěny, takže mají tři jednotky, které interagují a vytvářejí ortorombické krystalové uspořádání. Síranový anion je SO4dva- a je schopen darovat nebo přijímat čtyři vodíkové vazby, stejně jako NH kation4+.
Fyzikální a chemické vlastnosti
Molekulární váha
132,134 g / mol.
Fyzický vzhled
Plně bílá. Bílé nebo hnědé ortorombické krystaly, v závislosti na úrovních nečistot.
Zápach
Toaleta.
Bod tání
280 ° C Tato teplota tání, nízká ve srovnání s jinými iontovými sloučeninami, je způsobena skutečností, že se jedná o sůl s jednomocnými kationty (+1) a s odlišnými ionty v jejich velikostech, což způsobuje, že pevná látka má nízkou krystalickou mřížkovou energii..
Rozpustnost
76,4 g / 100 g vody při 25 ° C Tato afinita k vodě je způsobena velkou schopností jejích molekul solvatovat amonné ionty. Na druhé straně je nerozpustný v acetonu a alkoholu; tj. v rozpouštědlech méně polárních než voda.
Hustota
1,77 g / cm3 při 25 ° C.
Tlak páry
1871 kPa při 20 ° C.
Bod vzplanutí
26 ° C.
pH
5,0-6,0 (25 ° C, 1M roztok). Mírně kyselé pH je způsobeno hydrolýzou NH4+ ve vodě, produkující H3NEBO+ při nízkých koncentracích.
Stabilita
Stabilní za vhodných podmínek prostředí. Při kontaktu se silnými oxidačními činidly se může vznítit.
Rozklad
Začíná se rozkládat při 150 ° C a uvolňuje toxické výpary oxidu siřičitého, oxidu dusíku a amonia.
Koroze
Neútočí na železo nebo hliník.
Aplikace

V zemědělství
- Síran amonný se používá jako hnojivo v alkalických půdách. Amonná sůl má ve svém složení 21% dusíku a 24% síry. Existují však sloučeniny, které poskytují větší množství dusíku než síran amonný; jeho výhodou je jeho vysoká koncentrace síry.
- Síra je nezbytná při syntéze bílkovin, protože několik aminokyselin - například cystin, methionin a cystein - obsahuje síru. Z těchto důvodů je síran amonný i nadále jedním z nejdůležitějších hnojiv.
- Používá se při pěstování pšenice, kukuřice, rýže, bavlny, brambor, konopí a ovocných stromů.
- Snižuje pH alkalických půd díky svému příspěvku k nitrifikačnímu procesu prováděnému mikroby. Amoniak (NH4+) k výrobě dusičnanů (NO3-) a uvolněte H+: 2NH4+ + 4. místodva => 2NO3- + 2HdvaO + 4H+. Zvýšení koncentrace vodíku snižuje pH alkalických půd a umožňuje větší využití.
- Kromě použití jako hnojivo působí síran amonný jako doplněk rozpustných insekticidů, herbicidů a fungicidů, které se stříkají na plodiny..
- Síran je schopen sekvestrovat ionty přítomné v půdě a v závlahové vodě, které jsou nezbytné pro život určitých patogenů. Mezi ionty, které zachycuje síran amonný, patří Cadva+, Mgdva+, víradva+ a víra3+. Tato akce zvyšuje mikrobicidní účinek uvedených látek..
Jako analytické činidlo
Síran amonný působí jako srážecí činidlo při elektrochemické analýze, v mikrobiologickém kultivačním médiu a při přípravě amonných solí..
Při srážení a izolaci bílkovin
Síran amonný se používá při izolaci a čištění proteinů, zejména plazmatických. Do plazmy se přidá určité množství síranu amonného, aby se dosáhlo určité koncentrace; je tedy způsobeno srážení skupiny proteinů.
Sraženina se sebere odstředěním a k supernatantu se přidá další množství síranu amonného a při nové koncentraci dojde k vysrážení další skupiny proteinů..
Opakování předchozího procesu sekvenčním způsobem umožňuje ve výsledku získání různých frakcí plazmatických proteinů.
Než se objevily nové technologie molekulární biologie, umožnil tento postup izolaci plazmatických proteinů, které mají v medicíně velký význam, například: imunoglobuliny, koagulační faktory atd..
V průmyslu
Síran amonný působí zpomalením vzniku požáru v textilním průmyslu. Používá se jako přísada v galvanickém průmyslu. Používá se také při výrobě peroxidu vodíku, chloridu amonného atd..
Jiná použití
- Síran amonný se používá jako činidlo regulující osmotický tlak a jako srážecí činidlo soli..
- Ve formě laurylsulfátu amonného snižuje povrchové napětí vody, čímž umožňuje oddělení nečistot zvýšením tvrdosti vody..
- Je to antikorozní látka.
- Používá se jako přísada do potravin, která reguluje kyselost mouky a chleba.
Reference
- OECD SIDS. (Říjen 2004). Síran amonný. [PDF]. Citováno dne 27. dubna 2018 z: inchem.org
- Společnost Mosaic. (2018). Síran amonný. Citováno dne 27. dubna 2018 z: cropnutrition.com
- Wikipedia. (2018). Síran amonný. Citováno dne 27. dubna 2018 z: en.wikipedia.org
- Pubchem. (2018). Síran amonný. Citováno dne 27. dubna 2018, z: pubchem.ncbi.nlm.nih.gov UpSticksNGo Crew.
- (23. července 2015). [Postava]. Citováno dne 27. dubna 2018 z: flickr.com
- Paula Papp. (22. února 2017). Aplikace a použití síranu amonného. Citováno dne 27. dubna 2018 z: business.com


Zatím žádné komentáře