
Struktura kyseliny sulfanilové, vlastnosti, syntéza, použití

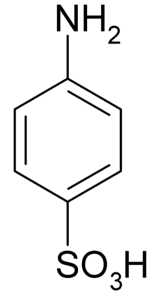
The kyselina sulfanilová je krystalická sloučenina, jejíž molekula je tvořena benzenovým kruhem, ke kterému je zásaditá skupina (-NHdva) a kyselá skupina (-SO3H). Jeho chemický vzorec je NHdvaC6H4SW3H.
Je také známá jako kyselina 4-aminobenzensulfonová. Připravuje se sulfonací anilinu v para poloze. Jeho krystaly jsou bílé nebo šedobílé. Jeho chování je více podobné chování soli než chování organické sloučeniny s NH skupinamidva medvěd3H. Proto je nerozpustný ve většině organických rozpouštědel.
Jedno z jeho hlavních použití je při syntéze barviv, protože snadno tvoří diazo sloučeninu, která je surovinou pro tuto aplikaci..
Kyselina sulfanilová i její deriváty se používají jako antibakteriální látky. Používá se při syntéze mukolytických sloučenin, protože mají schopnost snižovat viskozitu hlenu nebo vysoce viskózních biologických tekutin..
Používá se také v papírenském průmyslu a ve vzorcích pro rytiny nebo litografie. Je součástí pryskyřic, které se používají v betonových nebo maltových směsích a které jim umožňují dlouhodobě udržovat tekutost, aniž by to ovlivnilo dobu konečného tuhnutí..
Je to xenobiotický metabolit, to znamená, že ho přirozeně nevyrábí živé bytosti. Dráždí pokožku, oči a sliznice. Kromě toho může znečišťovat životní prostředí.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Hustota
- 3.5 Rozpustnost
- 3.6 Chemické vlastnosti
- 3.7 Další vlastnosti
- 4 Syntéza
- 5 použití
- 5.1 V průmyslu barviv
- 5.2 V analytické chemii
- 5.3 V medicíně jako antibakteriální látka
- 5.4 V medicíně jako mukolytický prostředek
- 5.5 V laboratořích pro biologické zkoušky
- 5.6 V papírenském průmyslu
- 5.7 V tiscích, rytinách nebo litografiích
- 5.8 Ve stavebních materiálech
- 6 Reference
Struktura
Kyselina sulfanilová má bílé krystaly tvořené ortorombickými nebo monoklinickými listy. Jeho monohydrát krystalizuje ve vodě ve formě ortorombických vrstev. Pokud krystalizace probíhá velmi pomalu, krystalizuje dihydrát. Monohydrát se stane bezvodým, když se blíží 100 ° C.
Nomenklatura
- Kyselina sulfanilová.
- Kyselina P-aminobenzensulfonová.
- Kyselina 4-aminobenzensulfonová.
Vlastnosti
Fyzický stav
Bílá nebo téměř bílá krystalická pevná látka.
Molekulární váha
173,19 g / mol.
Bod tání
Rozkládá se kolem 288 ° C bez roztavení. Uvádí se také při> 320 ° C.
Hustota
1,49 g / cm3
Rozpustnost
Téměř nerozpustný ve vodě: 10,68 g / l při 20 ° C.
Nerozpustný v ethanolu, benzenu a etheru. Mírně rozpustný v horkém methanolu.
Rozpustný ve vodných roztocích bází. Nerozpustný ve vodných roztocích minerálních kyselin. Rozpustný v koncentrované kyselině chlorovodíkové.
Chemické vlastnosti
Jeho vlastnosti se liší od vlastností jiných amino nebo sulfonovaných sloučenin, jsou podobné vlastnostem soli. Je to proto, že jeho struktura ve skutečnosti obsahuje skupiny -NH3+ A tak3-, což mu dává obojetné iontové vlastnosti.
Obsahuje kyselou skupinu a bazickou skupinu na opačných pólech stejné molekuly. Ale vodíkový iont je navázán na dusík místo na kyslík, protože skupina -NHdva je silnější základna než skupina -SO3-.
Protože se jedná o zwitterion, má vysokou teplotu tání a nerozpustnost v organických rozpouštědlech..
Kyselina sulfanilová je rozpustná v alkalickém roztoku, protože hydroxidový ion OH-, je silně bazický, začíná vodíkový iont (H+) slabé základní skupiny -NHdva, za vzniku p-aminobenzensulfonátového iontu, který je rozpustný ve vodě.
V kyselém roztoku se struktura kyseliny sulfanilové nemění, proto zůstává nerozpustná.
Další vlastnosti
Při zahřátí na rozklad emituje toxické výpary oxidů dusíku a síry.
Vystavení působení kyseliny sulfanilové může vést k příznakům, jako je podráždění kůže, očí a sliznic. Je to žíravá sloučenina.
Syntéza
Připravuje se reakcí anilinu s kyselinou sírovou (HdvaSW4) při vysokých teplotách. Zpočátku se tvoří kyselá aniliniumsulfátová sůl, která se při zahřátí na 180-200 ° C reorganizuje a vytvoří substituovaný kruh v para poloze, protože je to nejstabilnější produkt.
K jeho přípravě s vysokým stupněm čistoty se provede sulfonace směsi anilinu a sulfolanu s HdvaSW4 při 180-190 ° C.
Aplikace
V průmyslu barviv
Kyselina sulfanilová se používá při syntéze nebo přípravě různých barviv, jako je methylová oranžová a tartrazin. Za tímto účelem se diazotuje za vzniku diazotované kyseliny sulfanilové..
Je důležité si uvědomit, že tartrazin byl používán jako barvivo v potravinách. Jakmile je však požit, vytváří v lidském těle určité metabolity, včetně kyseliny sulfanilové, které jsou pravděpodobně zodpovědné za tvorbu reaktivních forem kyslíku. Mohou ovlivnit tkáně ledvin (ledvin) nebo jater (jater)..

V analytické chemii
Používá se jako činidlo při stanovení různých chemických sloučenin, včetně dusitanů..
V medicíně jako antibakteriální látka
Sulfanilamid, odvozený od kyseliny sulfanilové, má použití ve farmaceutickém průmyslu, protože má antibakteriální aktivitu.
V lidském těle si jej bakterie pletou s kyselinou p-aminobenzoovou, která je esenciálním metabolitem. Tato substituce znamená, že bakterie se nerozmnožují a neumírají.
Další derivát kyseliny sulfanilové, získaný kondenzací s jinými sloučeninami, má také antibakteriální vlastnosti, které jsou založeny na jeho schopnosti vytěsnit kyselinu listovou (součást komplexu vitaminu B)..
Tato sloučenina může být užívána orálně, injekčně intravenózně nebo externě aplikována v masti..
V medicíně jako mukolytický prostředek
Byl použit derivát kyseliny sulfanilové, který má mukolytickou aktivitu. To znamená, že představuje zkapalněnou aktivitu hlenu k rozpuštění samotného hlenu nebo velmi viskózních biologických tekutin.
Sloučenina může být použita k výrobě zkapalnění hlenu produkovaného tkání v důsledku patologických stavů. Například překrvení dýchacích cest nebo mimo jiné z vaginálního traktu.
Pokud jde o zkapalnění hlenu v dýchacích cestách, produkt se podává inhalací, kapkami do nosu, mlhou, aerosoly nebo nebulizéry. Jedná se o léčbu použitelnou u lidí nebo savců. Je to silnější sloučenina než sloučeniny založené na cysteinu.

Používá se také v laboratoři, když je žádoucí snížit viskozitu biologických tekutin, aby se usnadnilo analytické stanovení..
V laboratořích pro bioanalýzu
Při stanovení bilirubinu se používá diazotovaná kyselina sulfanilová (derivát připravený reakcí kyseliny sulfanilové s dusitanem sodným).
Bilirubin je žlutý pigment nacházející se ve žluči. Přebytek bilirubinu v krvi je důsledkem onemocnění jater, hematologických (nebo krevních) poruch nebo poruch žlučových cest.
K měření množství bilirubinu v krvi reaguje diazo odvozené od kyseliny sulfanilové s bilirubinem za vzniku komplexu azobilirubinu, jehož intenzita se měří kolorimetrem nebo spektrofotometrem. Tímto způsobem se stanoví obsah bilirubinu v krevním séru..
V papírenském průmyslu
Kyselina sulfanilová umožňuje syntetizovat leštidlo na papír, tj. Sloučeninu, která mu dodává optický lesk nebo bílý vzhled, protože neutralizuje žlutou barvu přírodního nebo neošetřeného papíru..

Má výhodu oproti jiným sloučeninám v tom, že může být použit v relativně vysokých koncentracích k ošetření papírenské buničiny za podmínek nízkého pH, aniž by došlo ke zvýšení nažloutlosti papíru..
Výsledek je evidentní, když je papír pozorován UV (ultrafialovým) světlem, pod kterým fluoreskuje mnohem více, než když se používají jiné sloučeniny, a při viditelném světle je pozorováno, že stupeň žloutnutí je velmi nízký.
Je velmi rozpustný ve vodě, což umožňuje jeho použití ve více koncentrovaných roztocích. Lze použít na jakýkoli typ papíru, včetně papíru vyrobeného z drcené buničiny, sulfitové buničiny nebo jiného procesu.
V tiscích, rytinách nebo litografiích
Kyselina sulfanilová funguje jako okyselovač v koncentrovaných roztocích pro litografii, aniž by představoval problémy s jinými kyselinami, jako je kyselina fosforečná, která je méně toxická a méně znečišťuje než druhá kyselina..
Ve stavebních materiálech
Vodné roztoky melamin-formaldehydové pryskyřice modifikované kyselinou sulfanilovou byly testovány v betonu (betonu), maltě nebo cementové pastě. Účelem bylo snížit obsah vody a zabránit snížení tekutosti směsi v průběhu času, aniž by se snížila doba tuhnutí..
Beton nebo malta připravená pomocí těchto roztoků jsou velmi účinné v létě, kdy je problémem snížení tekutosti v čase..
S těmito řešeními, pokud je malta nebo beton připraven a z jakéhokoli důvodu musí být ponechán v klidu, lze cementovou směs snadno nalít do forem nebo podobně, protože neztratila tekutost v průběhu času..

Reference
- Windholz, M. a kol. (redaktoři) (1983). Index společnosti Merck. Encyclopedia of Chemicals, Drugs and Biologicals. Desáté vydání. Merck & CO., Inc..
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Svazek 2. Čtvrté vydání. John Wiley & Sons.
- Národní lékařská knihovna. (2019). Kyselina sulfanilová. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Urist, H. a Martin, G.J. (1950). Deriváty kyseliny sulfanilové. US patent č. 2 504 471. Postupci Národní drogové společnosti. 18.dubna 1950.
- Villaume, Frederick G. (1964). Složení zjasňovače pro papír odvozený od methanilové a sulfanilové kyseliny. US patent č. 3 132 106. 5. května 1964.
- Martin, Tellis A. a Comer, William T. (1979). Derivát kyseliny benzoové a mukolytický proces s kyselinou benzensulfonovou. US patent č. 4,132,802. 2. ledna 1979.
- Druker, L.J. a Kincaid, R.B. (1979). Litografický koncentrát fontány. US patent č. 4 150 996. 24.dubna 1979.
- Shull, Bruce C. (1983). Stanovení bilirubinu. US patent č. 4,404,286. 13. září 1983.
- Uchida, J. a kol. (2001). Způsob přípravy vodného roztoku melamin-formaldehydové pryskyřice modifikovaného kyselinou sulfanilovou a cementové směsi. US patent č. 6 214 965 B1. 10. dubna 2001.
- Corradini, M.G. (2019). Svazek 1. V encyklopedii chemie potravin. Obnoveno ze sciencedirect.com.



Zatím žádné komentáře