
Vlastnosti, struktura, použití chloridu olovnatého
The chlorid olovnatý je anorganická sůl, jejíž chemický vzorec je PbCln, kde n je oxidační číslo olova. Když je tedy olovo +2 nebo +4, sůl je PbCldva nebo PbCl4, resp. Proto pro tento kov existují dva typy chloridů.
Z těchto dvou je PbCldva je nejdůležitější a stabilní; zatímco PbCl4 je nestabilní a méně užitečné. První je iontové povahy, kde je kation Pbdva+ generuje elektrostatické interakce s aniontem Cl- postavit krystalovou mříž; a druhá je kovalentní, s Pb-Cl vazbami vznikajícími olovo a chlored tetrahedron.

Dalším rozdílem mezi těmito dvěma chloridy olova je PbCldva Je to pevná látka bílých krystalů ve tvaru jehel (horní obrázek); zatímco PbCl4 Je to nažloutlý olej, který může krystalizovat při -15 ° C. Vstup PbCldva je estetičtější než PbCl4.
Kromě toho, co již bylo uvedeno, PbCldva v přírodě se vyskytuje jako minerál kotunit; zatímco PbCl4 ne, protože je náchylný k rozpadu. I když z PbCl4 můžete získat PbOdva, PbCldva odvozovat nekonečné množství organokovových sloučenin.
Rejstřík článků
- 1 Vlastnosti
- 1,1 - Olovnatý (II) chlorid
- 1.2 Chlorid olovnatý
- 2 Struktura
- 2,1-Olovnatý (II) chlorid
- 2.2 Molekula v plynné fázi
- 3 Názvosloví
- 4 použití
- 5 Reference
Vlastnosti
Vlastnosti chloridu olovnatého jsou v zásadě závislé na oxidačním počtu olova; protože chlór se nemění, ale způsob interakce s olovem ano. Proto je nutné obě sloučeniny řešit samostatně; chlorid olovnatý na jedné straně a chlorid olovnatý na druhé straně.
-Chlorid olovnatý
Molární hmotnost
278,10 g / mol.
Fyzický vzhled
Bílé barevné krystaly s tvary jehly.
Hustota
5,85 g / ml.
Bod tání
501 ° C.
Bod varu
950 ° C.
Rozpustnost ve vodě
10,8 g / l při 20 ° C Je špatně rozpustný a voda musí být zahřátá, aby se značné množství mohlo rozpustit.
Index lomu
2199.
Chlorid olovnatý
Molární hmotnost
349,012 g / mol.
Fyzický vzhled
Nažloutlá olejovitá kapalina.
Hustota
3,2 g / ml.
Bod tání
-15 ° C.
Bod varu
50 ° C Při vyšších teplotách se rozkládá a uvolňuje plynný chlor:
PbCl4(s) => PbCldva(s) + Cldva(G)
Ve skutečnosti se tato reakce může stát velmi výbušnou, takže PbCl je uložen.4 v kyselině sírové při -80 ° C.
Struktura
-Chlorid olovnatý
Nejprve bylo zmíněno, že PbCldva je iontová sloučenina, takže se skládá z iontů Pbdva+ a Cl- které vytvářejí krystal, ve kterém je stanoven poměr Pb: Cl rovný 1: 2; to znamená, že existuje dvakrát tolik Cl aniontů- jaké kationy Pbdva+.
Výsledkem je, že jsou vytvořeny ortorombické krystaly, jejichž ionty mohou být znázorněny pomocí modelu koulí a pruhů jako na obrázku níže..

Tato struktura také odpovídá struktuře kotunitového minerálu. I když se sloupce používají k označení směrovosti iontové vazby, neměla by být zaměňována s kovalentní vazbou (nebo alespoň čistě kovalentní).
V těchto ortorombických krystalech Pbdva+ (šedavé koule) má devět Cl- (zelené koule), které ho obklopují, jako by byl uzavřen do trojúhelníkového hranolu. Kvůli složitosti struktury a nízké iontové hustotě Pbdva+, pro molekuly je obtížné solvatovat krystal; důvod, proč je špatně rozpustný ve studené vodě.
Molekula plynné fáze
Když ani krystal, ani kapalina nevydrží vysoké teploty, ionty se začnou vypařovat jako molekuly PbCl.dva diskrétní; to znamená s kovalentními vazbami Cl-Pb-Cl a úhlem 98 °, jako by to byl bumerang. Potom se říká, že plynná fáze sestává z těchto molekul PbCldva a žádný z iontů nesených vzdušnými proudy.
Chlorid olovnatý
Mezitím PbCl4 je to kovalentní sloučenina. Proč? Protože kation Pb4+ je menší a má také vyšší hustotu iontového náboje než Pbdva+, což způsobuje větší polarizaci elektronového mraku Cl-. Výsledkem je, že místo interakce iontového typu Pb4+Cl-, je vytvořena kovalentní vazba Pb-Cl.
Vzhledem k tomu je podobnost mezi PbCl4 a například CCl4; oba se vyskytují jako jednotlivé čtyřboké molekuly. Je tedy vysvětleno, proč je tento chlorid olovnatý za normálních podmínek nažloutlý olej; Atomy Cl jsou navzájem špatně příbuzné a „sklouznou“, když dvě molekuly PbCl4 přicházejí.
Když však teplota klesne a molekuly se zpomalí, pravděpodobnost a účinky okamžitých dipólů (PbCl4 je apolární vzhledem ke své symetrii); a potom olej zmrzne jako žluté šestihranné krystaly:
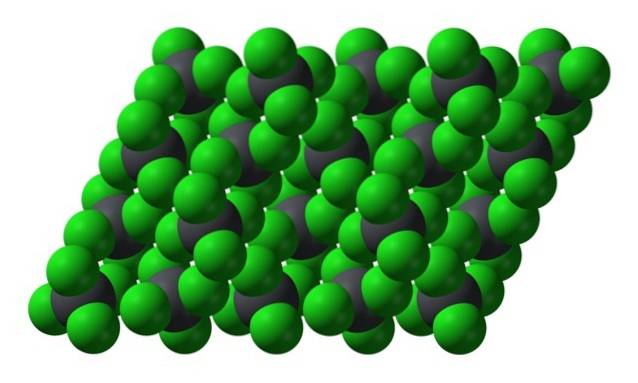
Všimněte si, že každá šedivá koule je obklopena čtyřmi zelenými koulemi. Tyto molekuly PbCl4 „Stlačené dohromady“ tvoří nestabilní krystal, který je citlivý na prudký rozklad.
Nomenklatura
Názvy: chlorid olovnatý (II) a chlorid olovnatý (IV) odpovídají názvům přiřazeným podle nomenklatury akcií. Vzhledem k tomu, že oxidační číslo +2 je nejnižší pro olovo a +4 nejvyšší, lze oba chloridy pojmenovat podle tradiční nomenklatury jako chlorid plumbózy (PbCldva) a chlorid olovnatý (PbCl4), v uvedeném pořadí.
A konečně je tu systematické názvosloví, které zdůrazňuje počet jednotlivých atomů ve sloučenině. Tedy PbCldva je chlorid olovnatý a PbCl4 chlorid olovnatý.
Aplikace
Neexistuje žádné známé praktické použití pro PbCl4 kromě toho, že slouží k syntéze PbOdva. Nicméně, PbCldva Je to užitečnější, a proto budou níže uvedena pouze některá použití tohoto konkrétního chloridu olovnatého:
- Vzhledem ke své vysoce luminiscenční povaze je určen pro fotografické, akustické, optické a radiační detektory.
- Protože neabsorbuje v oblasti infračerveného spektra, používá se k výrobě brýlí, které tento typ záření.
- Tvoří součást takzvaného zlatého skla, atraktivního materiálu s duhově namodralým zabarvením používaným pro okrasné účely..
- Rovněž pokračování v oboru, když byl alkalizován, PbCldvaPb (OH)dva Získává intenzivní bělavé tóny a používá se jako bílý olověný pigment. Jeho použití se však nedoporučuje kvůli jeho vysoké toxicitě..
- Roztaveno a smícháno s titanátem barnatým, BaTiO3, vzniká keramický olovo barnatan titaničitý Ba1 - xPbXStrýc3. Pokud Pbdva+ zadejte BaTiO3, a Badva+ musí opustit krystal, aby umožnil jeho zabudování, a potom se říká, že dochází k výměně kationtů; odtud složení Badva+ je vyjádřeno jako 1-x.
- A konečně z PbCldva syntetizuje se několik organokovových sloučenin olova obecného vzorce R.4Pb nebo R.3Pb-PbR3.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Chlorid olovnatý (II). Obnoveno z: en.wikipedia.org
- Chemická formulace. (2019). Chlorid olovnatý. Obnoveno z: formulacionquimica.com
- Clark Jim. (2015). Chloridy uhlíku, křemíku a olova. Obnoveno z: chemguide.co.uk
- Spektrální a optické nelineární studie chloridu olovnatého (PbCldva) krystaly. [PDF]. Obnoveno z: shodhganga.inflibnet.ac.in
- Národní centrum pro biotechnologické informace. (2019). Chlorid olovnatý. Databáze PubChem; CID = 24459. Obnoveno z: pubchem.ncbi.nlm.nih.gov


Zatím žádné komentáře