
Mechanismy galvanické koroze, příklady, ochrana
The galvanická nebo elektrochemická koroze Jedná se o proces, při kterém kov nebo slitina degraduje rychleji ve srovnání s konvenční oxidací. Lze říci, že se jedná o zrychlenou oxidaci, a to dokonce záměrně podporovanou; jak se to děje v článcích nebo bateriích.
K tomu dochází za řady podmínek. Nejprve musí existovat aktivní kov, který se nazývá anoda. A za druhé, musí existovat nízko reaktivní ušlechtilý kov zvaný katoda. Třetí a čtvrtá podmínka jsou přítomnost média, kde se množí elektrony, jako je voda, a iontové druhy nebo elektrolyty..

Galvanická koroze je pozorovatelná zejména v mořském prostředí nebo na pobřeží pláží. Vzduchové proudy zvyšují množství vodní páry, které zase nesou určité ionty; ty druhé nakonec přilnou k tenké vrstvě vody nebo kapek, které spočívají na kovovém povrchu.
Tyto podmínky vlhkosti a slanosti podporují korozi kovu. To znamená, že železná koruna, jako je ta na obrázku nahoře, bude rychleji rezat, bude-li vystavena blízkosti moře..
Snadnost, kterou bude kov muset oxidovat ve srovnání s jiným, lze kvantitativně měřit pomocí jeho redukčních potenciálů; knihy o chemii oplývají tabulkami s těmito potenciály E. Čím negativnější je, tím větší je jeho sklon k rezivění.
Podobně, pokud je tento kov v přítomnosti jiného s velmi pozitivním redukčním potenciálem, tedy s velkým ΔE, bude oxidace reaktivního kovu agresivnější. Důležité jsou také další faktory, jako je pH, iontová síla, vlhkost, přítomnost kyslíku a vztah mezi oblastmi oxidovaného a redukovaného kovu..
Rejstřík článků
- 1 Mechanismy
- 1.1 Koncepty a reakce
- 1.2 Depolarizátory
- 1.3 Koroze železa
- 2 Příklady
- 2.1 Anodické indexy
- 3 Ochrana proti elektrochemické korozi
- 3.1 Obětavé nátěry
- 3.2 Ušlechtilé povlaky
- 4 Experiment pro děti
- 4.1 Železná deska v roztoku solí mědi
- 4.2 Čištění oxidu stříbrného
- 5 Reference
Mechanismy
Koncepty a reakce
Než se budeme zabývat mechanismy, které stojí za galvanickou korozí, je třeba vyjasnit určité koncepty.
Při redoxní reakci jeden druh ztrácí elektrony (oxiduje), zatímco jiný je získává (redukuje). Elektroda, na které dochází k oxidaci, se nazývá anoda; a na kterém dochází k redukci, katoda (v angličtině mnemotechnické pravidlo redcat pamatovat si).
U elektrody (kusu, šroubu atd.) Z kovu M, pokud oxiduje, se říká, že je to anoda:
M => Mn+ + ne-
Počet uvolněných elektronů se bude rovnat velikosti kladného náboje kationtu M.n+ výsledný.
Poté další elektroda nebo kov R (oba kovy musí být nějakým způsobem v kontaktu) přijme uvolněné elektrony; ale toto nepodstupuje chemickou reakci, pokud získá elektrony, protože by je vedlo pouze (elektrický proud).
Proto musí existovat v roztoku jiný druh, který může tyto elektrony formálně přijmout; jako snadno redukované ionty kovů, například:
Rn+ + ne- => R.
To znamená, že by se vytvořila vrstva kovu R a elektroda by se proto stala těžší; zatímco kov M by ztratil hmotu v důsledku rozpouštění svých atomů.
Depolarizátory
Co kdyby neexistovaly žádné kovové kationty, které by bylo možné dostatečně snadno redukovat? V takovém případě vezmou elektrony jiné druhy přítomné v médiu: depolarizátory. Ty úzce souvisí s pH: Odva, H+, Ach- a HdvaNEBO.
Kyslík a voda získávají elektrony v reakci vyjádřené následující chemickou rovnicí:
NEBOdva + 2HdvaO + 4e- => 4OH-
Zatímco H ionty+ přeměnit na Hdva:
2H+ + 2e- => Hdva
To znamená druh OH- a Hdva jsou běžnými produkty galvanické nebo elektrochemické koroze.
I když se kov R nezúčastní žádné reakce, skutečnost, že je ušlechtilejší než M, podporuje jeho oxidaci; a v důsledku toho bude vyšší produkce OH iontů- nebo plynný vodík. Protože koneckonců je to rozdíl mezi redukčními potenciály, ΔE, jedním z hlavních hnacích mechanismů těchto procesů.
Koroze železa
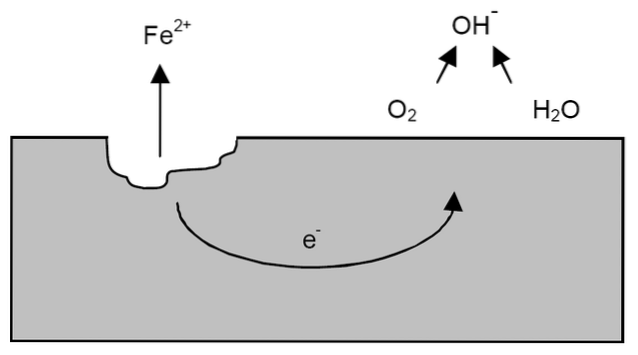
Po předchozích vyjasněních se můžeme věnovat příkladu koroze železa (horní obrázek). Předpokládejme, že existuje tenká vrstva vody, ve které se rozpouští kyslík. Bez přítomnosti dalších kovů budou pokyny pro reakci určovat depolarizátory.
Železo tedy ztratí některé atomy ze svého povrchu, aby se rozpustilo ve vodě jako kationty Fe.dva+:
Víra => Víradva+ + 2e-
Tyto dva elektrony budou cestovat kusem železa, protože je to dobrý vodič elektřiny. Takže je známo, kde začalo oxidační nebo anodové místo; ale ne tam, kde bude pokračovat redukce nebo umístění katodického místa. Místo katody může být kdekoli; a čím větší je jeho možná plocha, tím horší bude kov korodovat.
Předpokládejme, že elektrony dosáhnou bodu, jak je znázorněno na obrázku výše. Tam kyslík i voda procházejí již popsanou reakcí, při které se uvolňuje OH-. Tyto OH anionty- může reagovat s Fedva+ za vzniku Fe (OH)dva, který se vysráží a podrobí následným oxidacím, které jej nakonec přemění na rez.
Mezitím anodové místo stále více praská.
Příklady
V každodenním životě je příkladů galvanické koroze mnoho. Nemusíme odkazovat na železnou korunu: jakýkoli artefakt vyrobený z kovů může podstoupit stejný proces za přítomnosti vlhkého a slaného prostředí.
Kromě pláže může zima poskytnout také ideální podmínky pro korozi; například při odhazování solí do sněhu na silnici, aby se zabránilo smyku automobilů.
Z fyzikálního hlediska může být vlhkost zadržována ve svarových spojích dvou kovů, což jsou aktivní místa koroze. Je to proto, že se oba kovy chovají jako dvě elektrody a reaktivnější ztratí své elektrony..
Pokud je produkce iontů OH- Je značný, může dokonce korodovat barvu vozu nebo dotyčného zařízení.
Anodické indexy
Lze vytvořit vlastní příklady galvanické koroze s využitím tabulek redukčního potenciálu. Pro ilustraci tohoto bodu však bude vybrána anodická indexová tabulka (sama o sobě zjednodušená)..
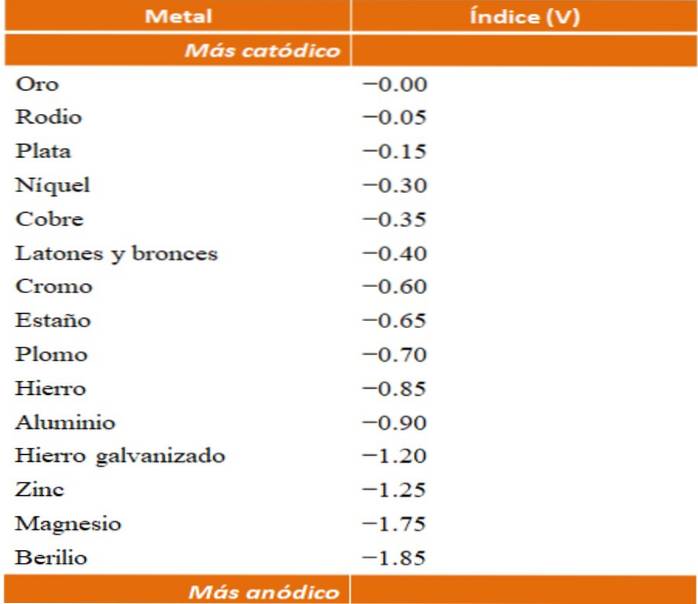
Předpokládejme například, že jsme chtěli postavit elektrochemický článek. Kovy, které jsou v horní části tabulky anodických indexů, jsou katodičtější; to znamená, že jsou snadno redukovány, a proto bude obtížné je najít v řešení. Zatímco kovy, které jsou na dně, jsou anodičtější nebo reaktivnější a snadno korodují.
Pokud zvolíme zlato a berylium, oba kovy by nemohly být spolu dlouho, protože berylium by extrémně rychle oxidovalo..
A pokud naopak máme roztok Ag iontů+ a ponoříme do něj hliníkovou tyč, to se rozpustí ve stejnou dobu, kdy se vysráží kovové částice stříbra. Pokud by tato tyč byla připojena k grafitové elektrodě, elektrony by k ní cestovaly, aby na ni elektrochemicky ukládaly stříbro jako stříbrný film..
A kdyby místo hliníkové tyče bylo vyrobeno z mědi, roztok by se stal modravým kvůli přítomnosti iontů Cu.dva+ ve vodě.
Elektrochemická ochrana proti korozi
Obětavé nátěry
Předpokládejme, že chcete chránit zinkový plech před korozí v přítomnosti jiných kovů. Nejjednodušší možností by bylo přidat hořčík, který by obalil zinek, takže jakmile se oxidují, elektrony uvolněné z hořčíku redukují kationty Zn.dva+ zadní.
Film MgO na zinku by však nakonec praskl spíše dříve než později, což by poskytlo místa anody s vysokou hustotou proudu; to znamená, že koroze zinku by se v těchto bodech prudce zrychlila.
Tato elektrochemická ochrana proti korozi je známá jako použití obětních povlaků. Nejznámější je zinek používaný ve slavné technice zvané galvanizace. V nich je kov M, zejména železo, potažen zinkem (Fe / Zn).
Zinek opět oxiduje a jeho oxid slouží k pokrytí železa a k přenosu elektronů, které redukují Fedva+ které lze formovat.
Ušlechtilé povlaky
Předpokládejme znovu, že chcete chránit stejnou vrstvu zinku, ale nyní použijete místo hořčíku chrom. Chrom je ušlechtilejší (katodičtější, viz tabulka anodických indexů) než zinek, a proto funguje jako ušlechtilý povlak.
Problém tohoto typu povlaku spočívá v tom, že jakmile praskne, bude dále podporovat a zrychlovat oxidaci kovu pod ním; v tomto případě by zinek korodoval ještě více, než by byl potažen hořčíkem.
A konečně existují další povlaky, které se skládají z barev, plastů, antioxidantů, tuků, pryskyřic atd..
Experiment pro děti
Železná deska při rozpouštění solí mědi
Jednoduchý experiment lze vymyslet ze stejné tabulky anodových indexů. Rozpuštění přiměřeného množství (méně než 10 gramů) CuSO45HdvaNebo ve vodě je dítě požádáno, aby se ponořilo do leštěné železné desky. Pořídí se fotografie a proces se může na několik týdnů rozvinout.
Řešení je zpočátku namodralé, ale začne mizet, zatímco železná deska změní barvu na měděnou. Je to proto, že měď je ušlechtilejší než železo, a proto jsou její kationty Cudva+ Budou redukovány na kovovou měď z iontů daných oxidací železa:
Víra => Víradva+ + 2e-
Cudva+ + 2e- => Cu
Čištění oxidem stříbrným
Stříbrné předměty časem zčernají, zvláště pokud jsou v kontaktu se zdrojem sloučenin síry. Jeho rzi lze odstranit ponořením předmětu do vany s vodou se sodou a hliníkovou fólií. Hydrogenuhličitan poskytuje elektrolyty, které usnadní transport elektronů mezi předmětem a hliníkem.
Výsledkem je, že dítě ocení, že předmět ztrácí své černé skvrny a bude zářit svou charakteristickou stříbrnou barvou; zatímco hliníková fólie koroduje a zmizí.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2019). Galvanická koroze. Obnoveno z: en.wikipedia.org
- Stephen Lower. (16. června 2019). Elektrochemická koroze. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Otevřená univerzita. (2018). 2.4 Korozní procesy: galvanická koroze. Obnoveno z: open.edu
- Zákaznický technický servisní štětec Wellman Inc. (s.f.). Průvodce galvanickou korozí. Kartáčujte Wellman Engineered Materials.
- Giorgio Carboni. (1998). Experimenty v elektrochemii. Obnoveno z: funsci.com



Zatím žádné komentáře