
Topná křivka, co to je, jak se to dělá, příklady
A topná křivka je grafické znázornění toho, jak se teplota vzorku mění v závislosti na čase, udržuje konstantní tlak a rovnoměrně přidává teplo, tj. konstantní rychlostí.
Pro konstrukci grafu tohoto typu se berou dvojice hodnot teploty a času, které se později grafují umístěním teploty na svislou osu (souřadnice) a času na vodorovnou osu (úsečka).

Poté se do těchto experimentálních bodů vloží nejvhodnější křivka a nakonec se získá graf teploty T jako funkce času t: T (t).
Rejstřík článků
- 1 Co je topná křivka?
- 1.1 - Změna skupenství látky
- 2 Jak vytvoříte topnou křivku?
- 3 Příklady (voda, železo ...)
- 3.1 Tání ledu
- 3.2 Přeměna vody na páru
- 4 Odkazy
Co je topná křivka?
Při zahřívání prochází látka postupně různými skupinami: z pevné látky se může stát pára a téměř vždy prochází kapalným stavem. Tyto procesy se nazývají změny stavu, při nichž vzorek zvyšuje svoji vnitřní energii, zatímco se přidává teplo, jak naznačuje molekulární kinetická teorie..
Při přidávání tepla do vzorku existují dvě možnosti:
- Látka zvyšuje svoji teplotu, protože její částice jsou míchány s větší intenzitou.
- Materiál prochází fázovou změnou, při které teplota zůstává konstantní. Přidání tepla má do určité míry za následek oslabení sil, které drží částice pohromadě, takže je snadné přejít například z ledu na kapalnou vodu.
Obrázek 2 ukazuje čtyři stavy hmoty: pevnou látku, kapalinu, plyn a plazmu a názvy procesů, které umožňují přechod mezi nimi. Šipky označují směr procesu.
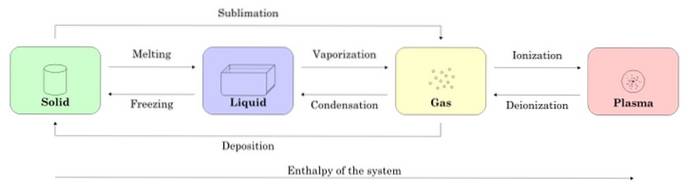
-Změny skupenství látky
Počínaje vzorkem v pevném stavu, když se roztaví, přejde do kapalného stavu, při odpařování se změní na plyn a ionizací se změní na plazmu.
Pevná látka může být převedena přímo na plyn způsobem známým jako sublimace. Existují látky, které snadno sublimují při pokojové teplotě. Nejznámější je COdva nebo suchý led, stejně jako naftalen a jód.
Zatímco vzorek prochází změnou stavu, teplota zůstává konstantní, dokud není dosaženo nového stavu. To znamená, že pokud například máte část kapalné vody, která dosáhla bodu varu, její teplota zůstane konstantní, dokud se veškerá voda nezmění na páru..
Z tohoto důvodu se očekává, že se křivka oteplování bude skládat z kombinace zvětšujících se úseků a vodorovných úseků, kde tyto odpovídají fázovým změnám. Obrázek 3 ukazuje jednu z těchto křivek pro danou látku.
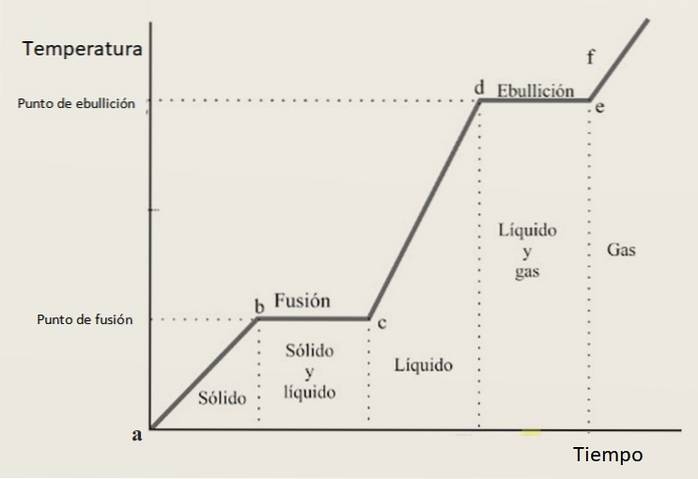
Interpretace topné křivky
V růstových intervalech ab, CD Y ef látka se nachází ve formě pevné látky, kapaliny a plynu. V těchto oblastech se zvyšuje kinetická energie as ní i teplota.
Mezitím v před naším letopočtem mění svůj stav z pevného na kapalný, proto obě fáze koexistují. Tak se to děje v sekci z, ve kterém se vzorek mění z kapaliny na plyn. Zde se mění potenciální energie a teplota zůstává konstantní.
Je také možný obrácený postup, to znamená, že vzorek lze ochladit, aby se postupně přijaly další stavy. V takovém případě mluvíme o křivka chlazení.
Topné křivky mají pro všechny látky stejný obecný vzhled, i když samozřejmě nemají stejné číselné hodnoty. Některým látkám trvá změna stavu déle než jiným a tají a odpařují se při různých teplotách..
Tyto body jsou známé jako teplota tání a teplota varu a jsou charakteristikami každé látky..
Proto jsou topné křivky velmi užitečné, protože udávají číselnou hodnotu těchto teplot pro miliony látek, které existují jako pevné látky a kapaliny v rozmezí teplot považovaných za normální a za atmosférického tlaku..
Jak děláte zahřívací křivku?
V zásadě je to velmi jednoduché: jednoduše vložte vzorek látky do nádoby vybavené míchadlem, vložte teploměr a rovnoměrně zahřejte..
Současně se při zahájení procedury aktivují stopky a čas od času se zaznamenají odpovídající páry teploty a času..
Zdrojem tepla může být plynový hořák s dobrou rychlostí ohřevu nebo elektrický odpor vydávající teplo při zahřátí, který lze připojit k proměnnému zdroji, aby se dosáhlo různých výkonů..
Pro větší přesnost jsou v chemické laboratoři široce používány dvě techniky:
- Diferenciální termická analýza.
- Diferenční skenovací kalorimetrie.
Porovnávají rozdíl teplot mezi studovaným vzorkem a jiným referenčním vzorkem s vysokou teplotou tání, téměř vždy oxidem hlinitým. S těmito metodami je snadné najít body tání a varu.
Příklady (voda, železo ...)
Vezměte v úvahu křivky ohřevu vody a železa zobrazené na obrázku. Časová stupnice není zobrazena, je však okamžité rozlišit teploty tání pro obě látky, které odpovídají bodu B každého grafu: pro vodu 0 ° C, pro železo 1500 ° C.
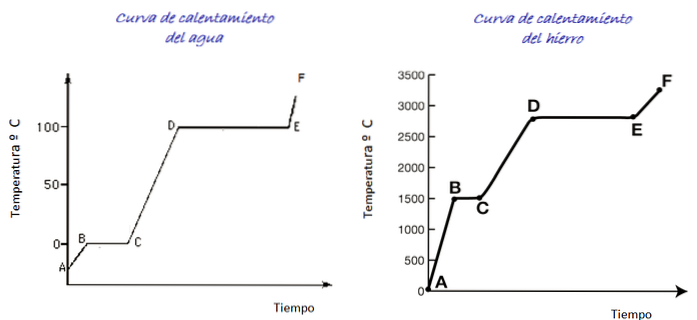
Voda je univerzální látka a rozsah teplot nutných k pozorování jejích změn stavu lze v laboratoři snadno dosáhnout. Pro železo jsou zapotřebí mnohem vyšší teploty, ale jak je uvedeno výše, tvar grafu se podstatně nemění..
Tání ledu
Při zahřívání vzorku ledu jsme podle grafu v bodě A při teplotě pod 0 ° C. Je pozorováno, že teplota stoupá konstantní rychlostí až do dosažení 0 ° C.
Molekuly vody v ledu vibrují s větší amplitudou. Jakmile je dosaženo teploty tání (bod B), molekuly se již mohou pohybovat před sebou.
Energie, která přichází, se investuje do snižování přitahovací síly mezi molekulami, takže teplota mezi B a C zůstává konstantní, dokud se nerozpustí veškerý led..
Měnící vodu na páru
Jakmile je voda zcela v kapalném stavu, vibrace molekul se opět zvyšují a teplota rychle stoupá mezi C a D až do bodu varu 100 ° C. Mezi D a E teplota zůstává na této hodnotě, zatímco energie, která přichází zajišťuje, že se veškerá voda v nádobě odpaří.
Pokud je v nádobě obsažena veškerá vodní pára, může pokračovat v ohřevu z bodu E do bodu F, jehož mez není v grafu uvedena..
Vzorek železa může projít stejnými změnami. Vzhledem k povaze materiálu jsou však teplotní rozsahy velmi odlišné..
Reference
- Atkins, P. Principles of Chemistry: The Paths of Discovery. Redakční Médica Panamericana. 219-221.
- Chung, P. Topné křivky. Obnoveno z: chem.libretexts.org.
- Topné křivky. Fúzní a odpařovací teplo. Obnoveno z: wikipremed.com.
- Hewitt, Paul. 2012. Konceptuální fyzikální věda. 5. Ed. Pearson. 174-180.
- University of Valladolid. Titul z chemie, získaný z: lodging.uva.es.


Zatím žádné komentáře