
Koncepty a příklady chemické dělitelnosti

Můžeme definovat dělitelnost v chemii jako vlastnost hmoty, která umožňuje její rozdělení na menší části. Abychom pochopili tento koncept, můžeme uvést příklad.
Vezmeme-li bochník chleba a znovu a znovu ho nakrájíme na polovinu, dostaneme se někdy k základnímu bloku hmoty, který nelze dále dělit? Tato otázka byla v myslích vědců a filozofů po tisíce let.
Původ a pojem chemické dělitelnosti
Po dlouhou dobu se debatovalo o tom, zda hmotu tvoří částice (to, co dnes známe jako atomy), ale obecná představa byla, že hmota je kontinuum, které lze rozdělit.
Tento rozšířený koncept způsobil, že se brilantní vědci jako James Clerk Maxwell (z Maxwellových rovnic) a Ludwing Boltzman (s Boltzmanovou distribucí) stali obětí posměchu, který vedl první k šílenství a druhý k sebevraždě..
V 5. století před naším letopočtem použil řecký filozof Leucippus a jeho žák Democritus slovo atomy k označení nejmenší jednotlivé části hmoty a navrhli, aby svět sestával pouze z atomů v pohybu..
Tato raná atomová teorie se od pozdějších verzí lišila tím, že zahrnovala myšlenku lidské duše složené z rafinovanějšího typu atomu distribuovaného po celém těle..
Atomová teorie upadla ve středověku do úpadku, ale byla oživena na začátku vědecké revoluce v 17. století..
Isaac Newton například věřil, že hmota se skládá z „pevných, masivních, tvrdých, neproniknutelných a pohyblivých částic“..
K dělitelnosti může dojít různými způsoby, nejběžnější je dělitelnost fyzikálními metodami, například sekáním jablka nožem.
K dělitelnosti však může dojít také chemickými metodami, kdy by hmota byla rozdělena na molekuly nebo atomy.
10 příkladů chemické dělitelnosti
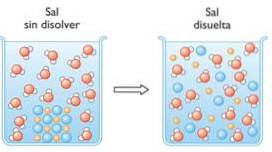
1 - Rozpusťte sůl ve vodě
Když se sůl, například chlorid sodný, rozpustí ve vodě, nastane solvatační jev, kdy dojde k porušení iontových vazeb soli:
NaCl → Na+ + Cl-
Rozpuštěním pouze zrnka soli ve vodě se rozdělí na miliardy iontů sodíku a chloridu v roztoku..
2 - Oxidace kovů v kyselém prostředí
Všechny kovy, například hořčík nebo zinek, reagují s kyselinami, například zředěnou kyselinou chlorovodíkovou za vzniku vodíkových bublin a bezbarvého roztoku chloridu kovu.
Mg + HCl → Mgdva+ +Cl- + Hdva
Kyselina oxiduje kov a odděluje kovové vazby, aby získala ionty v roztoku (BBC, 2014).
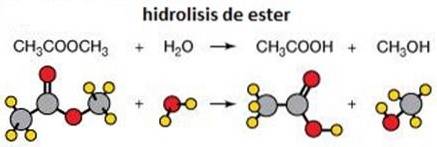
3 - Hydrolýza esterů
Hydrolýza je rozbití chemické vazby vodou. Příkladem hydrolýzy je hydrolýza esterů, kde jsou tyto rozděleny na dvě molekuly, alkohol a karboxylovou kyselinu..
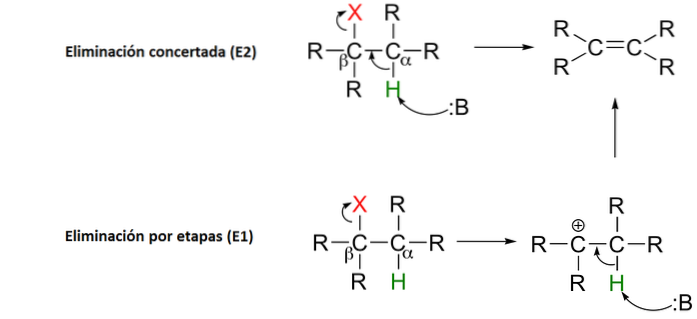
4 - Eliminační reakce
Eliminační reakce dělá přesně to, co říká: odstraňuje atomy z molekuly. Důvodem je vytvoření dvojné vazby uhlík-uhlík. To lze provést pomocí báze nebo kyseliny.
Může nastat v jediném koordinovaném kroku (abstrakce protonu na Cα vyskytující se současně s odštěpením vazby Cβ-X), nebo ve dvou krocích (štěpení vazby Cβ-X nastává nejprve za vzniku meziproduktu karbokace, která se pak „vypne“ abstrakcí protonu v alfa uhlíku).
5- Enzymatická reakce aldolázy
V přípravné fázi glykolýzy je jedna molekula glukózy rozdělena na dvě molekuly glyceraldehyd-3-fosfátu (G3P) pomocí 2 ATP.
Enzym odpovědný za tento řez je aldoláza, která se reverzní kondenzací rozdělí na dvě molekuly fruktózy 1,6-bisfosfátu v molekule G3P a molekulu dihydroxyaceton fosfátu, která se později izomerizuje za vzniku další molekuly G3P.
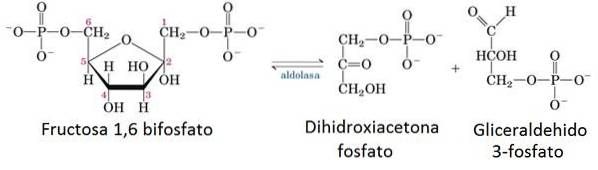
6- Degradace biomolekul
Nejen glykolýza, ale celá degradace biomolekul v katabolických reakcích jsou příklady chemické dělitelnosti.
Je to proto, že začínají z velkých molekul, jako jsou sacharidy, mastné kyseliny a bílkoviny, a produkují menší molekuly, jako je acetyl CoA, který vstupuje do Krebsova cyklu a vyrábí energii ve formě ATP.
7- Spalovací reakce
Toto je další příklad chemické dělitelnosti, protože komplexní molekuly, jako je propan nebo butan, reagují s kyslíkem za vzniku CO.dva a voda:
C3H8 + 5Odva → 3COdva + 4HdvaNEBO
O degradaci biomolekul lze říci, že jde o spalovací reakci, protože konečnými produkty jsou COdva a voda, nicméně tyto jsou podávány v mnoha krocích s různými zprostředkovateli.
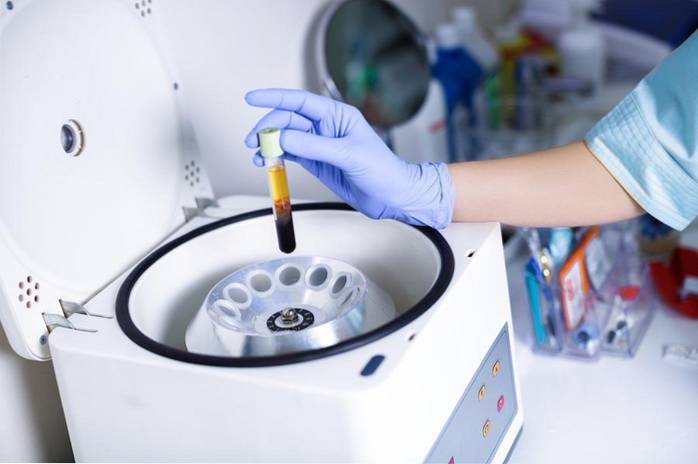
8- Centrifugace krve
Příkladem dělitelnosti je oddělení různých složek krve. Navzdory tomu, že jde o fyzický proces, zdá se mi příklad zajímavý, protože komponenty jsou odděleny rozdílem v hustotě centrifugací.
Nejhustší složky, sérum s červenými krvinkami, zůstanou na dně centrifugační zkumavky, zatímco méně husté složky, plazma, zůstanou nahoře..
9- Hydrogenuhličitanový pufr
Hydrogenuhličitan sodný, HCO3- Je to hlavní způsob přepravy COdva v těle produkt metabolických degradačních reakcí.
Tato sloučenina reaguje s protonem v médiu za vzniku kyseliny uhličité, která se následně rozdělí na CO2 a vodu:
HCO3- + H+ D HdvaCO3 D COdva + HdvaNEBO
Vzhledem k tomu, že reakce jsou reverzibilní, je to způsob, jakým má organismus prostřednictvím dýchání kontrolovat fyziologické pH, aby se vyhnul procesům alkalózy nebo acidózy.
10- Rozdělení atomu nebo štěpení jader
V případě, že se obrovské jádro (například uran-235) rozbije (štěpí), bude to mít za následek čistý energetický výnos. Je to proto, že součet hmotností fragmentů bude menší než hmotnost uranového jádra..
V případě, že hmotnost fragmentů je na vrcholu křivky vazebné energie stejná nebo větší než hmotnost železa, budou jaderné částice vázány těsněji než v jádru uranu a k tomuto úbytku hmotnosti dochází v energetické formě podle podle Einsteinovy rovnice.
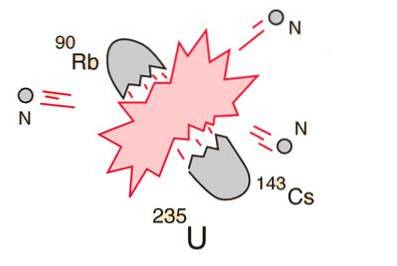
U prvků lehčích než železo bude fúze produkovat energii. Tento koncept vedl k vytvoření atomové bomby a jaderné energie..
Reference
- AJ Software a multimédia. (2015). Jaderné štěpení: základy. Obnoveno z atomicarchive.com.
- (2014). Reakce kyselin. Obnoveno z bbc.co.uk.
- Clark, J. (2016, leden). HYDROLYSING ESTERS. Obnoveno z chemguide.co.uk.
- Foist, L. (S.F.). Eliminační reakce v organické chemii. Obnoveno ze studie.com.
- Miller, W. A. (1867). Elements of Chemistry: Theoretical and Practical, Part 1. New York: John Wiley and son.
- Jaderné štěpení. (S.F.). Obnoveno z hyperfyziky.
- Pratt, D. (1997, listopad). Nekonečná dělitelnost hmoty. Obnoveno z davidpratt.info.
- Soderberg, T. (2016, 31. května). Eliminace pomocí mechanismů E1 a E2. Obnoveno z chem.libretext.

Zatím žádné komentáře