
Stupnice elektronegativity, variace, užitečnost a příklady

The elektronegativita je to relativní periodická vlastnost, která se týká schopnosti atomu přitahovat elektronovou hustotu ze svého molekulárního prostředí. Je to tendence atomu přitahovat elektrony, když je připojen k molekule. To se odráží v chování mnoha sloučenin a v tom, jak intermolekulárně interagují navzájem..
Ne všechny prvky přitahují elektrony ze sousedních atomů ve stejné míře. V případě těch, které snadno dávají elektronovou hustotu, se říká, že jsou elektropozitivní, zatímco ty, které jsou „pokryty“ elektrony, jsou elektronegativní. Existuje mnoho způsobů, jak vysvětlit a pozorovat tuto vlastnost (nebo koncept).
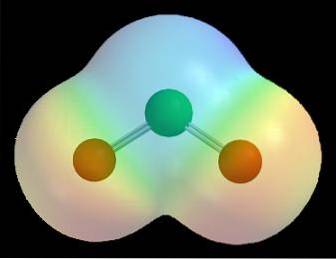
Například v mapách elektrostatického potenciálu pro molekulu (jako je ta pro oxid chloričitý na obrázku výše, ClOdva) je pozorován účinek různých elektronegativit pro atomy chloru a kyslíku.
Červená barva označuje elektronově bohaté oblasti molekuly δ- a modrá barva označuje elektronově chudé oblasti δ +. Po řadě výpočetních výpočtů tedy lze tento typ mapy stanovit; mnoho z nich vykazuje přímý vztah mezi umístěním elektronegativních atomů a δ-.
Lze jej také vizualizovat následovně: v molekule je tranzit elektronů pravděpodobnější v blízkosti nejvíce elektronegativních atomů. Z tohoto důvodu je to pro ClOdva atomy kyslíku (červené koule) jsou obklopeny červeným mrakem, zatímco atom chloru (zelená koule) jsou obklopeny modravým mrakem.
Definice elektronegativity závisí na přístupu daném jevu, existuje několik měřítek, které ji zvažují z určitých aspektů. Všechna měřítka však mají společné to, že jsou podporovány přirozenou povahou atomů.
Rejstřík článků
- 1 Váhy elektronegativity
- 1.1 Paulingova stupnice
- 1.2 Mullikenova stupnice
- 1.3 Stupnice A.L. Allred a E. Rochow
- 2 Jak se mění elektronegativita v periodické tabulce?
- 2.1 Atom v molekule
- 3 K čemu slouží?
- 4 Příklady (chlor, kyslík, sodík, fluor)
- 5 Reference
Váhy elektronegativity
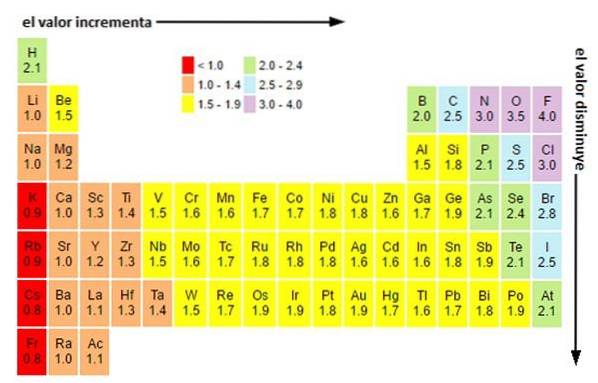
Elektronegativita není vlastnost, kterou lze kvantifikovat, ani nemá absolutní hodnoty. Proč? Protože tendence atomu přitahovat k němu hustotu elektronů není ve všech sloučeninách stejná. Jinými slovy: elektronegativita se liší v závislosti na molekule.
Ano pro molekulu ClOdva Pokud by byl atom Cl vyměněn za atom N, pak by se také změnila tendence O přitahovat elektrony; mohlo by se zvětšit (mrak bude červenější) nebo zmenšit (ztratit barvu). Rozdíl by spočíval v nové vytvořené vazbě N-O, která by tak měla molekulu O-N-O (oxid dusičitý, NOdva).
Jelikož elektronegativita atomu není stejná pro celé jeho molekulární okolí, je nutné ji definovat z hlediska dalších proměnných. Tímto způsobem existují hodnoty, které slouží jako reference a které umožňují předpovídat například typ vytvářené vazby (iontové nebo kovalentní).
Paulingova stupnice
Velký vědec a nositel dvou Nobelových cen, Linus Pauling, navrhl v roce 1932 kvantitativní (měřitelnou) formu elektronegativu známého jako Paulingova stupnice. V něm elektronegativita dvou prvků, A a B, tvořících vazby, souvisela s extra energií spojenou s iontovým charakterem vazby A-B.
Jak je to? Teoreticky jsou kovalentní vazby nejstabilnější, protože distribuce jejich elektronů mezi dvěma atomy je spravedlivá; to znamená, že pro molekuly A-A a B-B sdílejí oba atomy dvojici elektronů vazby stejným způsobem. Pokud je však A více elektronegativní, pak uvedená dvojice bude více A než B.
V takovém případě A-B již není zcela kovalentní, i když se jejich elektronegativity příliš neliší, lze říci, že jejich vazba má vysoký kovalentní charakter. Když k tomu dojde, vazba prochází malou nestabilitou a získává další energii jako produkt rozdílu elektronegativity mezi A a B.
Čím větší je tento rozdíl, tím větší je energie vazby A-B a v důsledku toho větší iontový charakter uvedené vazby..
Tato stupnice představuje nejpoužívanější v chemii a hodnoty elektronegativit vyplynuly z přiřazení hodnoty 4 atomu fluoru. Odtamtud mohli vypočítat, že z ostatních prvků.
Mullikenova stupnice
Zatímco Paulingova stupnice má co do činění s energií spojenou s vazbami, stupnice Roberta Mullikena souvisí spíše se dvěma dalšími periodickými vlastnostmi: ionizační energií (EI) a elektronovou afinitou (AE)..
Prvek s vysokými hodnotami EI a AE je tedy velmi elektronegativní, a proto přiláká elektrony ze svého molekulárního prostředí..
Proč? Protože EI odráží, jak obtížné je z něj „vytrhnout“ vnější elektron, a AE, jak stabilní je anion vytvořený v plynné fázi. Pokud mají obě vlastnosti vysokou velikost, pak je prvek „milovníkem“ elektronů..
Mullikenovy elektronegativity se počítají podle následujícího vzorce:
ΧM = ½ (EI + AE)
To znamená, χM se rovná průměrné hodnotě EI a AE.
Avšak na rozdíl od Paulingovy stupnice, která závisí na tom, které atomy tvoří vazby, souvisí s vlastnostmi valenčního stavu (s jeho nejstabilnější elektronickou konfigurací).
Obě stupnice generují podobné hodnoty elektronegativity pro prvky a jsou přibližně spojeny s následující rekonverzí:
ΧP = 1,35 (ΧM)1/2 - 1.37
Oba XM jako XP jsou to bezrozměrné hodnoty; to znamená, že jim chybí jednotky.
Stupnice A.L. Allred a E. Rochow
Existují i jiné stupnice elektronegativity, například Sandersonova a Allenova stupnice. Ten, který následuje po prvních dvou, je však stupnice Allred a Rochow (χAR). Tentokrát je založen na účinném jaderném náboji, který elektron zažívá na povrchu atomů. Proto to přímo souvisí s atraktivní silou jádra a efektem obrazovky..
Jak se mění elektronegativita v periodické tabulce?
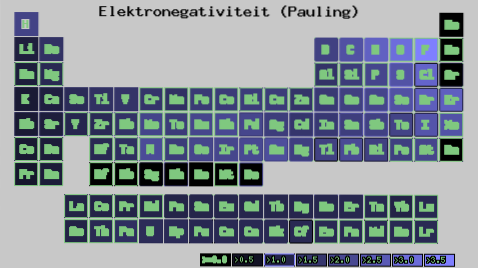
Bez ohledu na váhu nebo hodnoty, které máte, se elektronegativita po určitou dobu zvyšuje zprava doleva a ve skupinách zdola nahoru. Zvyšuje se tedy směrem k pravé horní úhlopříčce (nepočítaje helium), dokud nenarazí na fluor.
Na obrázku výše vidíte, co bylo právě řečeno. V periodické tabulce jsou Paulingovy elektronegativity vyjádřeny jako funkce barev buněk. Vzhledem k tomu, že fluor je nejvíce elektronegativní, má výraznější fialovou barvu, zatímco nejméně elektronegativní (nebo elektropozitivní) tmavší barvy..
Podobně lze pozorovat, že hlavy skupin (H, Be, B, C atd.) Mají světlejší barvy a že když jeden sestupuje skrz skupinu, ostatní prvky ztmavnou. O čem to je? Odpověď je opět jak ve vlastnostech EI, AE, Zef (efektivní jaderný náboj), tak v atomovém poloměru.
Atom v molekule
Jednotlivé atomy mají skutečný jaderný náboj Z a vnější elektrony trpí efektivním jaderným nábojem v důsledku účinku stínění..
Jak se pohybuje po určité období, Zef se zvyšuje takovým způsobem, že se atom smršťuje; to znamená, že atomové poloměry jsou po určitou dobu redukovány.
To má za následek, že v okamžiku propojení jednoho atomu s druhým budou elektrony „proudit“ směrem k atomu s nejvyšším Zefem. To také dává iontový charakter vazbě, pokud existuje výrazná tendence elektronů jít k atomu. Pokud tomu tak není, mluvíme o převážně kovalentní vazbě.
Z tohoto důvodu se elektronegativita mění podle atomových poloměrů Zef, které zase úzce souvisejí s EI a AE. Všechno je řetěz.
K čemu to je?
K čemu je elektronegativita? V zásadě lze určit, zda je binární sloučenina kovalentní nebo iontová. Když je rozdíl elektronegativity velmi vysoký (při rychlosti 1,7 jednotek nebo více), říká se, že sloučenina je iontová. Je také užitečné rozlišit ve struktuře, které oblasti budou pravděpodobně bohatší na elektrony..
Odtud lze předvídat, jaký mechanismus nebo reakci může sloučenina podstoupit. V oblastech chudých na elektrony může určitým způsobem působit δ +, negativně nabité druhy; a v oblastech bohatých na elektrony mohou jejich atomy interagovat velmi specifickými způsoby s jinými molekulami (interakce dipól-dipól).
Příklady (chlor, kyslík, sodík, fluor)
Jaké jsou hodnoty elektronegativity pro atomy chloru, kyslíku, sodíku a fluoru? Kdo je po fluoru nejvíce elektronegativní? Pomocí periodické tabulky se zjistilo, že sodík má tmavě fialovou barvu, zatímco barvy kyslíku a chloru jsou vizuálně velmi podobné..
Jeho hodnoty elektronegativity pro váhy Pauling, Mulliken a Allred-Rochow jsou:
Na (0,93; 1,21; 1,01).
Nebo (3,44; 3,22; 3,50).
Cl (3,16; 3,54; 2,83).
F (3,98; 4,43; 4,10).
U číselných hodnot je pozorován rozdíl mezi negativitami kyslíku a chloru.
Podle Mullikenovy stupnice je chlor na rozdíl od Paulingovy a Allred-Rochowovy váhy elektronegativnější než kyslík. Rozdíl elektronegativity mezi těmito dvěma prvky je ještě patrnější na stupnici Allred-Rochow. A konečně, fluor bez ohledu na zvolenou stupnici je nejvíce elektronegativní..
Pokud tedy v molekule existuje atom F, znamená to, že vazba bude mít vysoce iontový charakter..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání., Strany 30 a 44). Mc Graw Hill.
- Jim Clark. (2000). Elektronegativita. Převzato z: chemguide.co.uk
- Anne Marie Helmenstine, Ph.D. (11. prosince 2017). Definice a příklady elektronegativity. Převzato z: thoughtco.com
- Mark E. Tuckerman. (5. listopadu 2011). Stupnice elektronegativity. Převzato z: nyu.edu
- Wikipedia. (2018). Elektronegativita. Převzato z: es.wikipedia.org

Zatím žádné komentáře