
Potenciální ionizační energie, metody stanovení

The ionizační energie označuje minimální množství energie, obvykle vyjádřené v jednotkách kilojoulů na mol (kJ / mol), které je potřebné k vytvoření oddělení elektronu umístěného v atomu plynné fáze, který je v základním stavu.
Plynný stav označuje stav, ve kterém je prostý vlivu, který na sebe mohou vyvíjet jiné atomy, přičemž je vyloučena jakákoli mezimolekulární interakce. Velikost ionizační energie je parametr popisující sílu, s níž se elektron váže na atom, jehož je součástí..
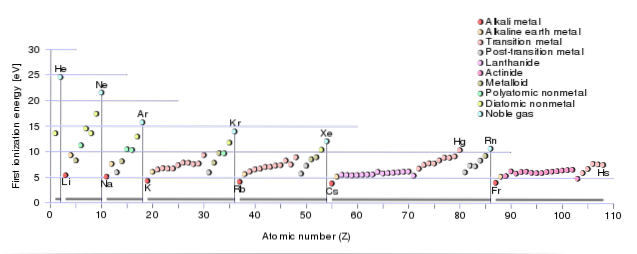
Jinými slovy, čím větší je množství ionizační energie, tím komplikovanější bude odpojení dotyčného elektronu..
Rejstřík článků
- 1 Ionizační potenciál
- 2 Metody stanovení ionizační energie
- 3 První ionizační energie
- 4 Druhá ionizační energie
- 5 Reference
Ionizační potenciál
Ionizační potenciál atomu nebo molekuly je definován jako minimální množství energie, které musí být aplikováno, aby došlo k oddělení elektronu od vnějšího pláště atomu v jeho základním stavu a s neutrálním nábojem; tj. ionizační energie.
Je třeba poznamenat, že když mluvíme o ionizačním potenciálu, používá se termín, který již není používán. Důvodem je, že dříve bylo stanovení této vlastnosti založeno na použití elektrostatického potenciálu pro sledovaný vzorek..
Použitím tohoto elektrostatického potenciálu došlo ke dvěma věcem: ionizace chemických látek a zrychlení procesu vylučování elektronu, který má být odstraněn..
Když tedy začínáme používat ke stanovení spektroskopické techniky, termín „ionizační potenciál“ byl nahrazen „ionizační energií“.
Podobně je známo, že chemické vlastnosti atomů jsou určeny konfigurací elektronů přítomných na nejvzdálenější energetické úrovni v těchto atomech. Ionizační energie těchto druhů tedy přímo souvisí se stabilitou jejich valenčních elektronů.
Metody stanovení ionizační energie
Jak již bylo zmíněno dříve, metody pro stanovení ionizační energie jsou dány hlavně fotoemisními procesy, které jsou založeny na stanovení energie emitované elektrony v důsledku aplikace fotoelektrického jevu..
Ačkoli by se dalo říci, že atomová spektroskopie je nejbezprostřednější metodou pro stanovení ionizační energie vzorku, existuje také fotoelektronová spektroskopie, při které se měří energie, s nimiž jsou elektrony vázány na atomy..
V tomto smyslu je ultrafialová fotoelektronová spektroskopie - také v angličtině známá jako UPS pro svou zkratku - je technika, která využívá excitaci atomů nebo molekul prostřednictvím aplikace ultrafialového záření..
To se provádí za účelem analýzy energetických přechodů nejvzdálenějších elektronů ve studovaných chemických druzích a charakteristik vazeb, které tvoří..
Známá je také rentgenová fotoelektronová spektroskopie a extrémní ultrafialové záření, které používají stejný princip, jaký byl dříve popsán, s rozdíly v typu záření, které je zasaženo vzorkem, rychlostí, s jakou jsou elektrony vypuzovány, a získaným rozlišením.
První ionizační energie
V případě atomů, které mají na své nejvzdálenější úrovni více než jeden elektron, tj. Takzvané polyelektronické atomy, je hodnota energie potřebné k odstranění prvního elektronu z atomu v základním stavu dána následující rovnice:
Energie + A (g) → A+(g) + e-
„A“ symbolizuje atom libovolného prvku a odpojený elektron je reprezentován jako „e-“. Takto je získána první ionizační energie, označovaná jako „I.1".
Jak je vidět, probíhá endotermická reakce, protože do atomu se dodává energie za účelem získání elektronu přidaného do kationu tohoto prvku.
Podobně se hodnota první ionizační energie prvků přítomných ve stejném období zvyšuje úměrně s nárůstem jejich atomového čísla..
To znamená, že klesá periodicky zprava doleva a shora dolů ve stejné skupině periodické tabulky..
V tomto smyslu mají ušlechtilé plyny vysoké ionizační energie, zatímco prvky alkalických kovů a kovů alkalických zemin mají tuto energii nízkou..
Druhá ionizační energie
Stejným způsobem, když je druhý elektron odstraněn ze stejného atomu, je získána druhá ionizační energie, symbolizovaná jako „Idva".
Energie + A+(g) → Adva+(g) + e-
Stejné schéma se používá i pro ostatní ionizační energie při spouštění následujících elektronů s vědomím, že po oddělení elektronu od atomu v jeho základním stavu se odpudivý účinek existující mezi zbývajícími elektrony sníží..
Protože vlastnost zvaná „jaderný náboj“ zůstává konstantní, je zapotřebí většího množství energie k odtržení dalšího elektronu iontového druhu, který má kladný náboj. Ionizační energie se tedy zvyšuje, jak je vidět níže:
Já1 < Idva < I3 <… < In
A konečně, kromě účinku jaderného náboje, jsou ionizační energie ovlivněny elektronickou konfigurací (počet elektronů ve valenčním plášti, typ okružní okupované atd.) A účinným jaderným nábojem vylučovaného elektronu..
Díky tomuto jevu má většina molekul organické povahy vysoké hodnoty ionizační energie..
Reference
- Chang, R. (2007). Chemistry, deváté vydání. Mexiko: McGraw-Hill.
- Wikipedia. (s.f.). Ionizační energie. Obnoveno z en.wikipedia.org
- Hyperfyzika. (s.f.). Ionizační energie. Citováno z hyperphysics.phy-astr.gsu.edu
- Field, F. H. a Franklin, J. L. (2013). Fenomeny nárazů elektronů: A vlastnosti plynných iontů. Obnoveno z books.google.co.ve
- Carey, F. A. (2012). Pokročilá organická chemie: Část A: Struktura a mechanismy. Získané z books.google.co.ve


Zatím žádné komentáře