
Struktura sfingomyelinu, funkce, syntéza a metabolismus
The sfingomyelin je to nejhojnější sfingolipid ve zvířecích tkáních: jeho přítomnost byla zjištěna ve všech dosud studovaných buněčných membránách. Má strukturální podobnosti s fosfatidylcholinem, pokud jde o skupinu polárních hlav, a proto je také klasifikován jako fosfolipid (fosfoshingolipid).
V 80. letech 19. století izoloval vědec Johann Thudichum lipidovou složku rozpustnou v etheru z mozkové tkáně a nazval ji sfingomyelin. Později, v roce 1927, byla struktura tohoto sfingolipidu označena jako N-acyl-sfingosin-1-fosfocholin.
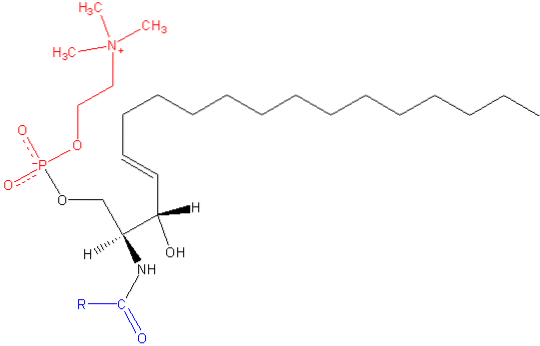
Stejně jako ostatní sfingolipidy má sfingomyelin strukturální i buněčné signální funkce a je obzvláště hojný v nervových tkáních, konkrétně v myelinu, obalu, který pokrývá a izoluje axony určitých neuronů.
Jeho distribuce byla studována pomocí experimentů subcelulární frakcionace a enzymatické degradace se sfingomyelinázami a výsledky ukazují, že více než polovina sfingomyelinu v eukaryotických buňkách se nachází v plazmatické membráně. To však záleží na typu buňky. Například ve fibroblastech tvoří téměř 90% celkových lipidů.
Dysregulace procesů syntézy a metabolismu tohoto lipidu vede k rozvoji komplexních patologických stavů nebo lipidózy. Příkladem je dědičná Niemannova-Pickova choroba charakterizovaná hepatosplenomegalií a progresivní neurologickou dysfunkcí.
Rejstřík článků
- 1 Struktura
- 2 funkce
- 2.1 - Označení
- 2.2 - Struktura
- 3 Syntéza
- 4 Metabolismus
- 5 Reference
Struktura
Sfingomyelin je amfipatická molekula složená z polární hlavy a dvou nepolárních ocasů. Skupina polárních hlav je molekula fosfocholinu, takže se může jevit podobně jako glycerofosfolipid fosfatidylcholin (PC). Mezi těmito dvěma molekulami však existují podstatné rozdíly týkající se mezifázové a hydrofobní oblasti..
Nejběžnější bází v savčí molekule sfingomyelinu je ceramid složený ze sfingosinu (1,3-dihydroxy-2-amino-4-oktadecen), který má dvojnou vazbu v trans mezi uhlíky v polohách 4 a 5 uhlovodíkového řetězce. Jeho nasycený derivát, sfinganin, je také běžný, ale nachází se v menší míře.
Délka hydrofobních ocasů sfingomyelinu se pohybuje od 16 do 24 atomů uhlíku a složení mastných kyselin se liší v závislosti na tkáni.
Například sfingomyeliny v bílé hmotě lidského mozku obsahují nervovou kyselinu, ty v šedé hmotě obsahují hlavně kyselinu stearovou a převládající formou v krevních destičkách je arachidonát..
Obecně existuje rozdíl v délce mezi dvěma řetězci mastných kyselin sfingomyelinu, který, jak se zdá, upřednostňuje jevy „interdigitace“ mezi uhlovodíky v opačných monovrstvách. To poskytuje membráně speciální stabilitu a zvláštní vlastnosti ve srovnání s jinými membránami, které jsou chudší na tento sfingolipid..
V mezifázové oblasti molekuly má sfingomyelin amidovou skupinu a volný hydroxyl na uhlíku 3, které mohou sloužit jako donory a akceptory vodíkových vazeb pro intra- a intermolekulární vazby, důležité při definici postranních domén a interakce s různými. typy molekul.
Funkce
-Signalizace
Produkty metabolismu sfingosinů - ceramid, sfingosin, sfingosin 1-fosfát a diacylglycerol - jsou důležitými buněčnými efektory a dávají mu roli v mnoha buněčných funkcích, jako je apoptóza, vývoj a stárnutí, buněčná signalizace, mimo jiné..
-Struktura
Díky trojrozměrné „válcové“ struktuře sfingomyelinu může tento lipid vytvářet kompaktnější a uspořádanější membránové domény, což má důležité funkční důsledky z hlediska proteinu, protože může vytvořit specifické domény pro některé integrální membránové proteiny.
V lipidových „vorech“ a jeskyních
Lipidové rafty, membránové fáze nebo uspořádané mikro domény sfingolipidů, jako je sfingomyelin, některé glycerofosfolipidy a cholesterol, představují stabilní platformy pro asociaci membránových proteinů s různými funkcemi (receptory, transportéry atd.).
Caveolae jsou invaginace plazmatické membrány, které přijímají proteiny pomocí GPI kotev a jsou také bohaté na sfingomyelin.
Ve vztahu k cholesterolu
Cholesterol díky své strukturní tuhosti významně ovlivňuje strukturu buněčných membrán, zejména v aspektech souvisejících s tekutostí, a proto je považován za základní prvek.
Protože sfingomyeliny mají jak donory, tak akceptory vodíkových vazeb, předpokládá se, že jsou schopné vytvářet „stabilnější“ interakce s molekulami cholesterolu. Proto se říká, že existuje pozitivní korelace mezi hladinami cholesterolu a sfingomyelinu v membránách..
Syntéza
Syntéza sfingomyelinu probíhá v komplexu Golgi, kde je ceramid transportovaný z endoplazmatického retikula (ER) modifikován přenosem molekuly fosfocholinu z fosfatidylcholinu za současného uvolňování molekuly diacylglycerolu. Reakce je katalyzována SM syntázou (ceramid: fosfatidylcholin fosfocholin transferáza).
Existuje také další cesta pro výrobu sfingomyelinu, která může nastat přenosem fosfoethanolaminu z fosfatidylethanolaminu (PE) na ceramid s následnou methylací fosfoethanolaminu. To je považováno za zvláště důležité v některých nervových tkáních bohatých na PE..
Sfingomyelin syntáza se nachází na luminální straně Golgiho komplexu membrány, což je v souladu s extra cytoplazmatickým umístěním sfingomyelinu ve většině buněk.
Kvůli charakteristikám polární skupiny sfingomyelinu a zjevné nepřítomnosti specifických translocases závisí topologická orientace tohoto lipidu na enzymové syntáze..
Metabolismus
K degradaci sfingomyelinu může dojít jak v plazmatické membráně, tak v lysozomech. Lysozomální hydrolýza na ceramid a fosfocholin závisí na kyselé sfingomyelináze, rozpustném lysozomálním glykoproteinu, jehož aktivita má optimální pH kolem 4,5.
Hydrolýza v plazmatické membráně je katalyzována sfingomyelinázou, která pracuje při pH 7,4 a pro svůj provoz vyžaduje dvojmocné ionty hořčíku nebo manganu. Další enzymy podílející se na metabolismu a recyklaci sfingomyelinu se nacházejí v různých organelách, které se navzájem spojují vezikulárními transportními cestami..
Reference
- Barenholz, Y., a Thompson, T. E. (1999). Sfingomyelin: biofyzikální aspekty. Chemie a fyzika lipidů, 102, 29-34.
- Kanfer, J., & Hakomori, S. (1983). Sfingolipidová biochemie. (D. Hanahan, ed.), Příručka výzkumu lipidů 3 (1. vyd.). Plenum Press.
- Koval, M. a Pagano, R. (1991). Intracelulární transport a metabolismus sfingomyelinu. Biochimické, 1082, 113-125.
- Lodish, H., Berk, A., Kaiser, C. A., Krieger, M., Bretscher, A., Ploegh, H., Martin, K. (2003). Molekulární buněčná biologie (5. vydání). Freeman, W. H. & Company.
- Millat, G., Chikh, K., Naureckiene, S., Sleat, D. E., Fensom, A. H., Higaki, K., ... Vanier, M. T. (2001). Niemann-Pickova choroba typu C: Spektrum mutací HE1 a korelace genotypů / fenotypů ve skupině NPC2. Am. J. Hum. Genet., 69, 1013-1021.
- Ramstedt, B., & Slotte, P. (2002). Membránové vlastnosti sfingomyelinů. FEBS Dopisy, 531, 33-37.
- Slotte, P. (1999). Interakce sfingomyelinu a cholesterolu v biologických a modelových membránách. Chemie a fyzika lipidů, 102, 13-27.
- Vance, J. E., a Vance, D. E. (2008). Biochemie lipidů, lipoproteinů a membrán. v New Comprehensive Biochemistry Vol.36 (4. vydání). Elsevier.



Zatím žádné komentáře